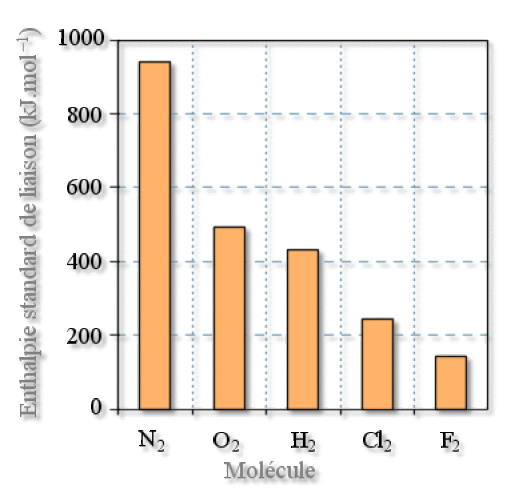
Stabilité
C'est une molécule moyennement stable. Sa réaction de dissociation :
\(\textrm{Cl}_2 \textrm{(g)}\leftrightarrow2.\textrm{Cl (g)}\)
correspond à une variation d'enthalpie modérée : \(\Delta_{\textrm{diss}}H=+243 \textrm{kJ.mol}^{-1}\)
Par exemple, à \(1000 °\textrm C\), le dichlore est déjà dissocié à 0,2 %, ce qui n'est pas négligeable.
D'ailleurs, on peut également casser cette liaison avec un rayonnement Ultra-Violet (longueur d'onde inférieure à 200 nm - soit de l'UV proche).
La valeur de l'enthalpie de liaison de \(\textrm{Cl}_2\), qui a un indice de liaison (\(\textrm{i.l.}\)) égal à 1 est notablement plus faible que celle de \(\textrm N_2\) (\(\textrm{i.l.}=3\)) ou\( \textrm O_2\) (\(\textrm{i.l.}=2\)) mais plus élevée que celle de \(\textrm F_2\) (\(\textrm{i.l.}=1\)).