Les halogénures d'alcalins
Partie
Question
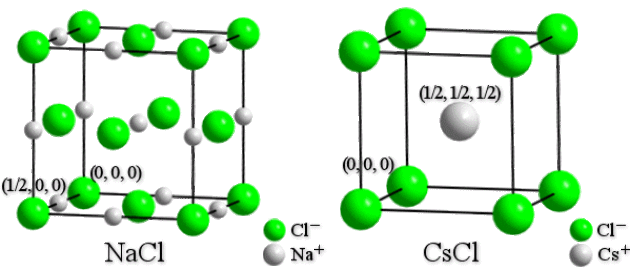
Les halogénures alcalins cristallisent dans une structure de type \(\textrm{NaCl}\) ou \(\textrm{CsCl}\).
Représenter ces deux types structuraux en perspective cavalière. Décrire ces deux structures en indiquant plus particulièrement la nature de l'empilement anionique, la localisation des cations dans ces structures et leur coordinence, le nombre de groupements formulaires.
La masse volumique de \(\textrm{NaCl (s)}\) est \(\rho=2\textrm,170\textrm{ g.cm}^{-3}\). Calculer le paramètre de la maille cristalline. Sachant que le rayon des ions chlorures est \(R_{\textrm{Cl}^-}=0\textrm,181\textrm{ nm}\), les ions chlorures sont-il tangents entre eux dans la structure \(\textrm{NaCl}\) ?
Quelle doit être la valeur du rayon de l'ion alcalin \(r^+\) pour que dans chacune de ces structures les ions \(\textrm{Cl}^-\) d'une part, les ions alcalins et \(\textrm{Cl}^-\) d'autre part, soient tangents entre eux ?
Données :
\(M_{\textrm{Na}}=23\textrm{ g.mol}^{-1}\)
\(M_{\textrm{Cl}}=35\textrm,5\textrm{ g.mol}^{-1}\)
Nombre d'Avogadro : \(N_A=6\textrm,02.10^{23}\textrm{ mol}^{-1}\)
Solution détaillée
1.
\(\textrm{NaCl}^\)
Empilement cubique faces centrées d'atomes de chlore avec tous les sites octaédriques occupés par les atomes de sodium. La coordinence du sodium est donc [6]. Il y a 4 groupements formulaires par maille (\(Z=4\)).
Les positions des atomes dans la maille sont :
\(\textrm{Cl}^- : \textrm(0\textrm,0\textrm,0\textrm{),(}\frac{1}{2}\textrm,\frac{1}{2}\textrm,0\textrm{),(}\frac{1}{2}\textrm,0\textrm,\frac{1}{2}\textrm{),(}0\textrm,\frac{1}{2}\textrm,\frac{1}{2}\textrm)\)
\(\textrm{Na}^+ : \textrm(\frac{1}{2}\textrm,0\textrm,0\textrm{),(}0\textrm,\frac{1}{2}\textrm,0\textrm{),(}0\textrm,0\textrm,\frac{1}{2}\textrm{),(}\frac{1}{2}\textrm,\frac{1}{2}\textrm,\frac{1}{2}\textrm)\)
Ce qui revient à considérer les positions \(\textrm(0,0,0)\) pour les atomes de chlore et \(\textrm(\frac{1}{2},0,0)\) pour les atomes de sodium et un centrage de type \(\textrm F\).
\(\textrm{CsCl}\)
Empilement cubique simple d'atomes de chlore avec le site cubique occupé par un atome de césium. La coordinence du césium est donc [8]. Il y a 1 groupement formulaire par maille (\(Z=1\)).
Les positions des atomes dans la maille sont :
\(\textrm{Cl}^- : (0\textrm,0\textrm,0)\)
\(\textrm{Cs}^+ : (\frac{1}{2}\textrm,\frac{1}{2}\textrm,\frac{1}{2})\)
b. Masse volumique : \(\rho=\frac{ZM_\textrm{NaCl}}{N_AV}=\frac{4\times58\textrm,5}{6\textrm,02.10^{23}\times a^3}=2\textrm,170\textrm{ g.cm}^{-3}\)
\(a=\sqrt[3]{\frac{4 \times \mathrm{58,5}}{\mathrm{6,02} . 10^{23} \times \mathrm{2,170}}} = \mathrm{5,637} . 10^{-8} \textrm{cm} = \mathrm{5,637} \stackrel{\circ}{\textrm{A}}\)
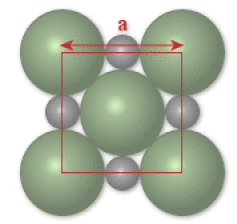
Si il y a tangence entre les atomes de chlore, la relation suivante doit être vérifiée :
\(4R_{\textrm{Cl}^-}=a\sqrt2\) ou \(4R_{\textrm{Cl}^-}=4\times \mathrm{1,81}=\mathrm{7,24}\stackrel{\circ}{\textrm{A}}\) et \(a\sqrt2=\mathrm{7,97} \stackrel{\circ}{\textrm{A}}\)
Donc il n'y a pas contact entre les atomes de chlore.
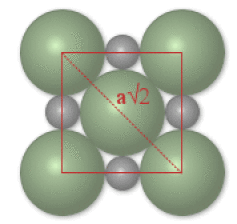
3. Tangence anion-cation
\(\textrm{NaCl} :\)
Comme le montre la figure ci-contre le contact entre les sphères de \(\textrm{Na}^+\) et \(\textrm{Cl}^-\) se fait selon l'arête de la maille.
\(2\times (R_{\textrm{Cl}^-}+R_{\textrm{Na}^+})=a\)
\(\textrm{CsCl} :\)
Le contact entre les sphères de \(\textrm{Cs}^+\) et \(\textrm{Cl}^-\) se fait selon la grande diagonale de la maille.
\(2\times (R_{\textrm{Cl}^-}+R_{\textrm{Cs}^+})=a\sqrt3\)