Molécules comportant des centres asymétriques et des doubles liaisons donnant lieu à l'isomérie Z-E
Des centres asymétriques et des doubles liaisons donnant lieu à isomérie \(Z - E\) peuvent coexister au sein d'une même molécule. Pour identifier et nommer tous les stéréoisomères d'un tel composé il faut chercher :
les centres asymétriques (nomenclature \(\textrm R\), \(\textrm S\))
les doubles liaisons donnant lieu à l' isomérie \(Z - E\).
Exemple : Le 4-chloropent-2-ène
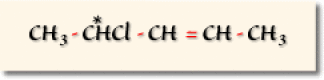
On trouve un carbone asymétrique donnant lieu à deux arrangements possibles et une double liaison qui conduit aussi à deux arrangements possibles. Il en résulte un nombre total de : \(2^{1+1}=4\) combinaisons représentées dans l'illustration suivante.
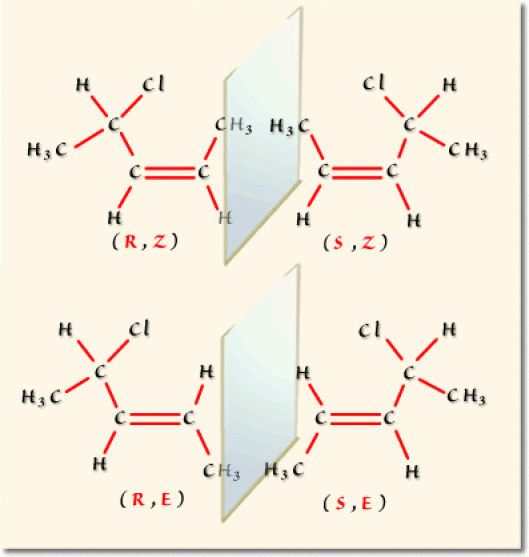
Ces quatre stéréoisomères se divisent en deux couples d'énantiomères.
Attention :
Deux énantiomères possèdent obligatoirement la même configuration \(Z\) ou \(E\).
Règle : Généralisation
Lorsqu'une molécule comporte \(n\) carbones asymétriques et \(m\) double liaisons donnant lieu à isomérie \(Z - E\), le nombre de combinaisons ou stéréoisomères est de \(2^{n+m}\). Ils se répartissent en \(\frac{2^{n+m}}{2}\) ou \(2^{n+m-1}\) couples d'énantiomères.
Attention :
Lorsqu'il apparaît des éléments de symétrie excluant la chiralité dans certains stéréoisomères, le nombre total de stéréoisomères devient évidemment \(<2^{n+m}\).