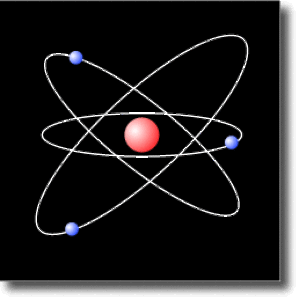
Instabilité de l'atome planétaire
La conception de la structure des atomes qui émergeait au début du vingtième siècle empruntait pour l'essentiel à un modèle classique de type planétaire. A la suite des travaux d'Ernest Rutherford (1911), il fut admis que l'atome pouvait s'apparenter à un noyau de charge positive autour duquel orbitent des particules chargées négativement : les électrons. La cohésion de l'édifice atomique résulte de la force de Coulomb jouant pour l'atome le rôle de la force de gravitation dans un système planétaire.
Ce modèle planétaire souffrait cependant d'une incohérence liée aux lois de l'électromagnétisme. En effet, les particules chargées en mouvement accéléré sont susceptibles d'émettre un rayonnement lumineux.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Le mouvement de rotation d'un électron autour du noyau fait que le champ électrique créé par le dipôle que constituent les deux particules chargées varie au cours du temps : ce dipôle électron-proton change d'orientation au fur et à mesure que l'électron tourne autour du proton.
L'atome crée donc un champ électrique oscillant, c'est-à-dire une onde électromagnétique. L'atome perd alors continuement de l'énergie sous forme électromagnétique.
La conservation de l'énergie totale implique que l'énergie rayonnée correspond à une perte d'énergie mécanique de l'électron. Celui-ci perd alors de "l'altitude". Le terme inéluctable de sa trajectoire est la collision avec le noyau.
La durée de vie calculée est de l'ordre de 10-8 seconde. La réalité est évidemment tout autre ; les atomes sont stables et n'émettent pas spontanément de lumière.