Surfaces d'isodensité (orbitales s et p)
Les orbitales de type \(\textrm s\) ne varient pas avec les angles et leurs surfaces d'isodensité sont donc des sphères. On a représenté ci-contre en haut ces surfaces pour les orbitales \(1\textrm s, 2\textrm s \textrm{et} 3\textrm s\) de l'hydrogène à \(10^{-3} \AA^{-3}\).
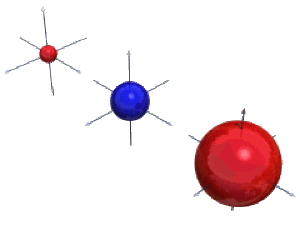
Pour les orbitales \(1\textrm s\), on obtient une seule sphère alors que pour les orbitales \(2\textrm s\) et \(3\textrm s\), on obtient en fait 3 et 5 sphères respectivement, qui apparaissent en raison de l'existence de plusieurs maxima, visibles sur les représentations radiales, que l'on peut aussi lier à l'existence d'un nombre croissant de sphères nodales avec le nombre quantique principal. Ces sphères supplémentaires sont cachées dans la figure ci-dessus.

Pour rappeler l'existence des sphères nodales, on a choisi de représenter ci-contre de deux couleurs différentes, en ménageant une ouverture dans les sphères, les surfaces correspondant à une densité de \(10^{-3} \AA^{-3}\) mais des valeurs opposées de l'orbitale \(2\textrm s\).
La sphère nodale est située entre les sphères rouge et bleue internes.
Ce type de figure ne doit pas être confondu avec les surfaces d'isodensité présentées page précédente pour l'orbitale \(2\textrm p\), qui montrent des surfaces obtenues pour plusieurs valeurs de la densité.
Les orbitales \(2\textrm p\) et \(3\textrm p\) réelles sont représentées ci-dessous pour une valeur particulière de la densité. On constate là encore l'augmentation du nombre d'éléments nodaux avec le nombre quantique principal :
un plan nodal pour les \(2\textrm p\)
un plan nodal et une sphère nodale pour les \(3\textrm p\)
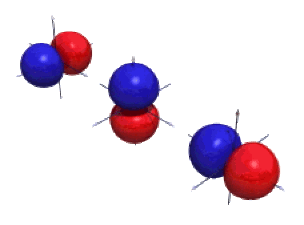

Des versions sont disponibles ci-dessous pour les orbitales \(2\textrm p\) et \(3\textrm p\).
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.