La notion de configuration électronique
Définir une configuration électronique consiste à spécifier le peuplement des sous-couches. Pour écrire une configuration, on aligne les symboles des sous-couches que l'on affecte d'un exposant donnant la population de la sous-couche.
Ainsi, si on considère la configuration du lithium (\(Z=3\)) dans laquelle on affecte deux électrons à la sous-couche \(1\textrm s\) et un électron à la sous-couche \(2\textrm s\), on écrit alors cette configuration sous la forme :
\(1\textrm s^22\textrm s^1\)
En vertu de la règle de Pauli, on ne peut mettre plus de deux électrons sur l'orbitale \(1\textrm s\).
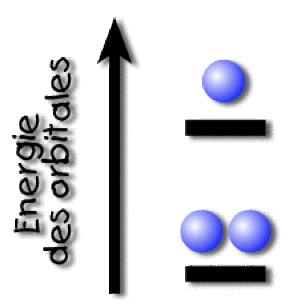
La configuration 1s2 2s1 du lithium
La configuration de l'état fondamental est celle qui conduit à l'énergie la plus basse. Dans le modèle des électrons indépendants, l'énergie totale étant la somme des énergies des orbitales occupées, elle s'obtient en peuplant les orbitales de plus basse énergie.
Pour le néon (\(Z=10\)) par exemple, la configuration de l'état fondamental est
\(1\textrm s^22\textrm s^22\textrm p^6\)
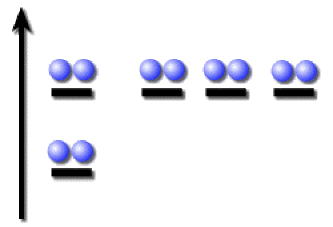
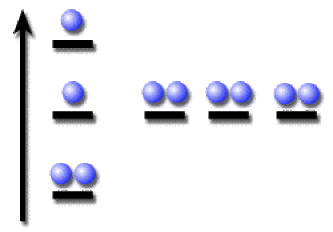
Une configuration "excitée" pouvant être :
\(1\textrm s^22\textrm s^12\textrm p^63\textrm s^1\)
On verra dans la suite que connaître la configuration électronique d'un atome est d'une importance extrême si l'on veut comprendre les propriétés chimiques des éléments.
Le nombre et le type des orbitales peuplées dans un état électronique donné d'un atome gouvernent sa capacité à interagir avec d'autres atomes.