L'énergie potentielle moléculaire
L'énergie potentielle moléculaire de la molécule \(\textrm H_2\) obtenue dans l'approximation LCAO est calculable analytiquement. Quelques détails de calcul sont donnés ici[1]. Elle est tracée ci-dessous en comparaison du résultat exact issu d'un modèle plus sophistiqué.
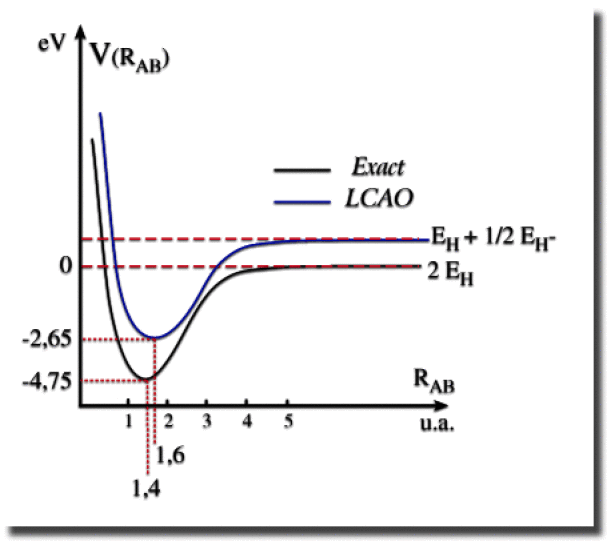
Le modèle des orbitales moléculaires prédit bien l'existence d'un puits d'énergie potentielle et donc la stabilité de la molécule. La distance d'équilibre dans l'approximation LCAO simple est de 1,6 Bohr, soit 0,84 Angström. La profondeur du puits relative à deux atomes d'hydrogène séparés à l'infini l'un de l'autre vaut 2,65 eV. Les valeurs expérimentales sont 0,74 Angström et 4,75 eV respectivement. Le modèle doit donc être amélioré pour reproduire les valeurs expérimentales. Pour un accord plus quantitatif avec les données expérimentales, il faut notamment utiliser un développement LCAO utilisant des orbitales atomiques supplémentaires.
L'asymptote horizontale aux grandes distances internucléaires ne correspond pas à la somme des énergies de deux atomes d'hydrogène. Le modèle ne prédit pas correctement la rupture homolytique de la liaison covalente. C'est un défaut intrinsèque au modèle : la forme de la fonction d'onde est inadaptée pour décrire deux atomes d'hydrogène éloignés.
On peut notamment montrer que la fonction d'onde modèle conduit à une probabilité égale de dissociation en deux atomes d'hydrogène neutres (\(\textrm H + \textrm H\)) ou en une paire d'ions (\(\textrm H^+ + \textrm H^-\)). Puisque les deux électrons peuvent se trouver sur le même atome et former un anion \(\textrm H^-\), il s'en suit que la répulsion entre ces deux électrons ne s'annule jamais, même lorsque les deux atomes sont infiniment loins l'un de l'autre,
On retiendra que le modèle des orbitales moléculaire permet de traduire la stabilité de la liaison covalente mais n'est pas adapté à la description de sa rupture et de sa formation.