Énergie potentielle moléculaire de l'ion H2+
Partie
Question
L'énergie électronique associée à l'orbitale moléculaire \(\sigma_{\mathrm{g}}\) de l'ion\( \mathrm{H_2^+}\) est donnée par l'expression suivante :
\(\langle\mathrm{E_g}\rangle=\mathrm{E_H}+\frac{\mathrm{I_{AB}+J_{AB}}}{1+\mathrm{S}}\)
On donne les expressions de \(\mathrm{I_{AB}}\), \(\mathrm{J_{AB}}\) et \(\mathrm{S}\) en fonction de \(\mathrm{R}\) :
\(\mathrm{I_{AB}}=\frac{1}{\mathrm{R}}-\exp(-2\mathrm{R})\left[1+\frac{1}{\mathrm{R}}\right]\)
\(\mathrm{J_{AB}}=\exp(-\mathrm{R})[1+\mathrm{R}]\)
\(\mathrm{S}=\exp(-\mathrm{R})\left[1+\mathrm{R}+\frac{\mathrm{R}^2}{3}\right]\)
\(\mathrm{I_{AB}}\) et \(\mathrm{J_{AB}}\) sont exprimés en Hartree et \(\mathrm{R}\) en Bohr.
\(\mathrm{E_H}\) est l'énergie de l'orbitale 1s d'un atome d'hydrogène.
1. Exprimer en Hartree l'énergie \(\mathrm{V_{AB}(R)}\) de répulsion entre les deux noyaux d'hydrogène en fonction de \(\mathrm{R}\).
2. Exprimer l'énergie potentielle moléculaire \(\mathrm{E(R)}\) associée à l'état fondamental de l'ion \(\mathrm{H}_2^+\).
3. Tracer la courbe d'énergie potentielle entre 0 et 10 Bohr et déterminer graphiquement la distance d'équilibre de la liaison \(\mathrm{R_e}\) et l'énergie potentielle de liaison \(\Delta\mathrm{E}\) de l'ion moléculaire en électron-Volt.
Comparer aux valeurs expérimentales :
\(\mathrm{R_e}=1,06\AA\)
\(\Delta\mathrm{E}=2,73~\mathrm{eV}\)
Aide simple
On rappelle les conversions suivantes :
\(1~\mathrm{Hartree}=27,21~\mathrm{eV}\)
\(1~\mathrm{Bohr}=0,529~\AA\)
Aide méthodologique
Il faut éviter les formules trop longues et garder à l'esprit que les applications numériques sont plus aisées lorsque l'on calcule les grandeurs " par morceaux ". Il est donc inutile de donner la formule de\( \mathrm{E}\) explicitement en fonction de \(\mathrm{R}\). On ne donnera que son expression en fonction des grandeurs\( \mathrm{I_{AB}}\), \(\mathrm{J_{AB}}\), \(\mathrm{S}\) et \(\mathrm{V_{AB}}\) que l'on calculera séparément.
Aide à la lecture
Il s'agit de construire l'expression de l'énergie potentielle moléculaire et de la tracer en fonction de \(\mathrm{R}\) pour déterminer les paramètres importants qui caractérisent la force de la liaison.
Solution détaillée
1 – Les deux noyaux sont composés chacun d'un proton (Z = 1). En unité atomique, l'énergie de répulsion coulombienne entre ces deux protons est de la forme :
\(\mathrm{V_{AB}(R)}=\frac{1}{\mathrm{R}}\)
2 – L'énergie potentielle moléculaire est la somme de l'énergie électronique et de l'énergie de répulsion nucléaire :
\(\mathrm{E(R)=\langle~E_g\rangle+V_{AB}=E_H+\frac{I_{AB}+J_{AB}}{1+S}+\frac{1}{R}}\)
3 – Le tracé de la courbe d'énergie potentielle est donné ci-dessous. La distance d'équilibre de la liaison (ou longueur de liaison) \(\mathrm{R_e}\) correspond au minimum de l'énergie potentielle. Elle est environ de 2,5 u.a., soit \(1,32\AA\). Elle est plus longue que la distance réelle \((1,06\AA)\) en raison des approximations du modèle LCAO.
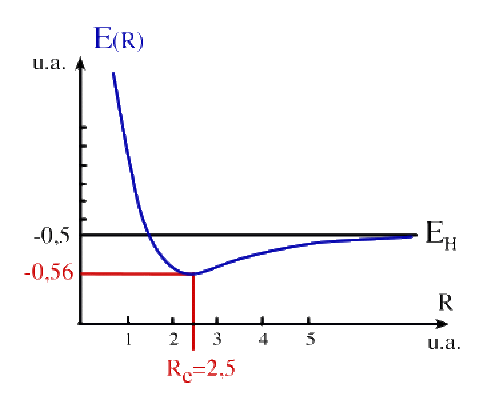
L'énergie potentielle de liaison est la différence entre l'énergie des fragments et l'énergie de l'ion moléculaire dans sa conformation la plus stable, à la distance d'équilibre. Quand les deux fragments sont séparés à l'infini, on obtient un atome d'hydrogène et un proton (d'énergie nulle). On trouve :
\(\Delta\mathrm{E=E(\infty)-E(R_e)=E(H+H^+)-E(R_e)=E_H-E(R_e)}\)
L'application numérique donne :
\(\mathrm{E_H}=-0,5~\mathrm{Hartree}=-13,6~\mathrm{eV}\)
\(\mathrm{E(R_e)}=-0,56~\mathrm{Hartree}=-15,23~\mathrm{eV}\)
Soit \(\Delta\mathrm{E}=1,63~\mathrm{eV}\). La valeur expérimentale est de 2,73 eV.
La méthode LCAO prédit une liaison trop faible et trop longue.