Les orbitales de valence
Considérons un atome de la seconde ligne de la classification, de type \(\textrm{AX}_2\) ou \(\textrm{AXE}\) dans la nomenclature VSEPR. Ses deux hybrides \(\textrm{sp}\) peuvent être utilisées pour décrire deux liaisons chimiques axiales ou encore une liaison et une paire libre.
Les deux hybrides appartiennent à la couche de valence : elles sont formées d'orbitales \(2\textrm s\) et \(2\textrm p\). Pour décrire complètement la valence de l'atome, il faut aussi tenir compte des autres orbitales de la couche 2 : les deux orbitales \(2\textrm p\) non affectées par l'hybridation, dont les axes de révolution sont perpendiculaires à l'axe de liaison. Ces orbitales peuvent être vides ou occupées.
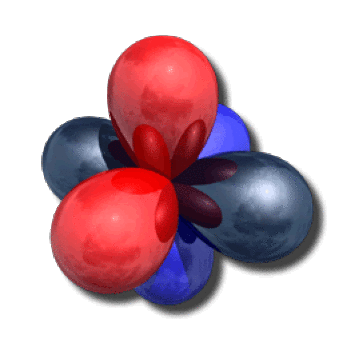
Sur la figure ci-contre, on a représenté ces quatre orbitales de valence : les deux hybrides \(\textrm{sp}_1\) et \(\textrm{sp}_2\) (reflets métalliques) et les deux orbitales \(2\textrm p\) (en bleu et rouge) qui sont orthogonales aux hybrides.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Ce type d'hybridation est adapté aux molécules linéaires.
Exemple : La molécule BeH2
Dans la molécule \(\textrm{BeH}_2\) par exemple, le béryllium est de type \(\textrm{AX}_2\) ; les deux électrons de valence sont affectés aux hybrides \(\textrm{sp}\) et les deux orbitales \(2\textrm p\) restent vides.
Exemple : La molécule BH
Dans la molécule \(\textrm{BH}\), le bore est de type \(\textrm{AXE}\). L'électron de liaison et la paire libre sont affectés aux hybrides \(\textrm{sp}\) et les orbitales \(2\textrm p\) sont vides.
Exemple : La molécule HCN
Dans la molécule \(\textrm{HCN}\) par contre, le carbone est de type \(\textrm{AX}_2\) mais possède 4 électrons de valence. Deux électrons sont affectés aux hybrides (un à chaque hybride) pour former des liaisons axiales \(\textrm{CN}\) et \(\textrm{CH}\), mais les orbitales \(2\textrm p\) portent chacune un électron.