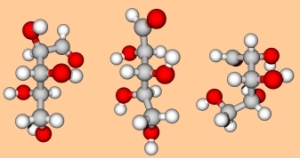
Conditions
La libre rotation des atomes autour des axes des simples liaisons permet aux oses d'adopter de multiples conformations.
Comme toutes les molécules, les oses ne sont pas des structures rigides et rectilignes. Les atomes ont une certaine liberté de rotation autour des axes de leurs liaisons. Cette libre rotation n'est limitée que par la taille des atomes et par leurs possibilités de rapprochement et d'interactions. Une molécule en solution peut adopter une multitude de formes, résultant chacune d'un arrangement spatial relatif des carbones et de leurs substituants. Ces formes sont appelées conformations, conformères, ou encore rotamères.
Ces modèles moléculaires reproduisent trois rotamères probables du D-(-)-ribose en solution. Le passage d'une conformation à une autre s'effectue par simple rotation des atomes autour de leurs axes de liaisons et ne met en jeu que de faibles différences d'énergie interne, facilement compensées par l'agitation thermique. En solution, le D-(-)-ribose change constamment de conformation.
Complément : Simuler
Simuler la libre rotation des liaisons dans une molécule de D-ribose
Cette animation interactive illustre le rôle de la libre rotation dans les changements de conformation d'un ose en solution.
Certaines conformations recourbées sont stabilisées par des interactions entre groupements fonctionnels.
Lorsque la longueur du squelette le permet, les conformères recourbés sont également favorisés par des interactions entre groupes fonctionnels. C'est par exemple ce qui se passe dans un ose lorsqu'une conformation amène l'hydroxyle d'un alcool en interaction avec la fonction dérivée du carbonyle (aldéhyde ou cétone). Les deux groupements fonctionnels interagissent parce qu'ils constituent des dipôles inverses (les alcools secondaires, généralement plus polarisés que les alcools primaires, se prêtent mieux à ce type d'interaction). En solution, cette interaction est en équilibre avec une liaison chimique entre C1 et l'oxygène de l'alcool, qui ferme la molécule en une structure cyclique.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Une conformation recourbée d'un aldose (ici le D-(-)-ribose) est stabilisée par interaction entre l'alcool du C4 et le carbonyle du C1, qui se comportent comme des dipôles opposés (δ-δ+). Dans des conditions favorables, cette interaction se transforme en une liaison covalente entre l'oxygène (O) et le carbone (1), formant cycle.
Un hémiacétal est fondamentalement instable.
Le cycle est fermé par un groupe fonctionnel hémiacétal cyclique. En règle générale, les hémiacétals sont fondamentalement instables car ils lient deux hétéroatomes (deux oxygènes) au même carbone tétragonal C1 (aldoses) ou C2 (cétoses). En solution, le cycle s'ouvre et se ferme très souvent. Les conséquences de ce comportement sont décrites dans le paragraphe Mutarotation. Toutefois, la forme cyclisée apportant un net avantage structural sur la forme ouverte, elle possède une durée de vie plus longue et est donc plus abondante en solution. A partir de cinq carbones, la forme ouverte représente à chaque instant généralement moins de 0,1% des molécules.
Le principe chimique de la formation d'un hémiacétal, et son implication dans la cyclisation des oses sont détaillés dans le paragraphe Additions réversibles de Propriétés.