Principaux cycles des oses
Furanoses et pyranoses sont les deux formes cycliques majoritairement adoptées par les oses.
Compte-tenu de la flexibilité du squelette carboné et des angles de courbure permis par les atomes, les cycles les plus répandus dans la nature comportent :
5 atomes (4 carbones et 1 oxygène) = furanoses.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
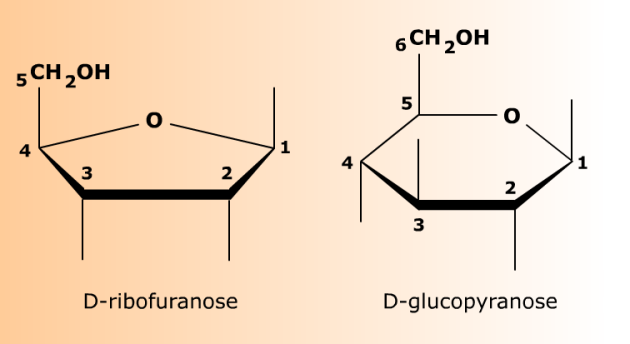
Le cycle du D-ribofuranose comporte 5 atomes. Il s'agit des carbones 1, 2, 3, 4, et de l'oxygène (O) ayant servi à fermer le cycle. Le carbone 5 et son alcool primaire sont rejetés à la périphérie du cycle et constituent un groupe exocyclique. La formule plane de droite est souvent appelée "Fischer cyclisé" ou encore "représentation de Tollens".
6 atomes (5 carbones et 1 oxygène) = pyranoses.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Le cycle du D-glucopyranose comporte 6 atomes. Il s'agit des carbones 1, 2, 3, 4 et 5 et de l'oxygène (O) ayant servi à fermer le cycle. Le carbone 6 et son alcool primaire sont rejetés à la périphérie du cycle (groupe exocyclique). La formule plane de droite est souvent appelée "Fischer cyclisé" ou encore "représentation de Tollens".
La représentation de Haworth simplifie l'écriture des structures cycliques et permet de retrouver la formule de Fischer de l'ose avant cyclisation.
La représentation graphique de Haworth, aussi appelée représentation plane, symbolise les cycles par des polygones plans vus en perspective (un renforcement du trait est censé montrer les liaisons proches de l'observateur). Par convention, les groupements -OH des alcools secondaires en configuration R sont représentés au dessous des sommets des polygones, tandis que ceux des alcools en configuration S s'écrivent au dessus. Par convention également, tout ce qui est porté par le carbone dont l'alcool a servi à la cyclisation (groupe exocyclique) est représenté au dessus du plan du cycle quand la configuration de ce carbone est R, et au dessous du cycle quand elle est S.
Complément :
Le cycle est symbolisé par un pentagone (furanoses) ou un hexagone (pyranoses) en semi-perspective. Les positions des atomes du cycle, en particulier celle de l'oxygène, doivent être respectées. Comme dans la formule de Fischer, il suffit de représenter les hydroxyles des alcools secondaires par de simples traits.
Rappel : La représentation d'un ose selon Haworth
Dans certains cas de cyclisation, il peut apparaître délicat de placer correctement les substituants des carbones asymétriques sur une représentation de Haworth. Ceci est particulièrement vrai pour le placement des groupements exocyliques (CH2OH par exemple) lorsque la cyclisation utilise un alcool secondaire. Voici quelques astuces pour effectuer l'opération sans ambigüité.
Identifier le carbone sub-terminal (ou carbone de référence). C'est le carbone asymétrique le plus éloigné de la fonction aldéhyde ou cétone, sur la chaîne carbonée la plus longue.
Faire tourner le carbone sub-terminal et ses substituants d'un quart de tour pour amener le OH dans l'axe du squelette carboné. C'est donc un quart de tour dans le sens des aiguilles d'une montre dans le cas d'un ose de la série D, et un quart de tour en sens inverse des aiguilles d'une montre dans le cas d'un ose de la série L. Dans cette opération le groupe exocyclique passe à gauche ou à droite de la formule.
Tous les substituants des carbones asymétriques qui sont maintenant à gauche de la projection de Fischer apparaîtront au dessus du plan du cycle dans la représentation de Haworth et, inversement, tous les substituants qui sont à droite de la projection de Fischer apparaîtront en dessous du plan du cycle.
En cas de doute, il est encore possible d'imaginer une rotation de la projection de Fischer à l'horizontale, ce qui facilite la vision des positions des substituants vers le "haut" et vers le "bas" sur la feuille de papier.
Il ne reste plus, pour achever la représentation, qu'à placer l'oxygène du cycle (c'est celui de l'alcool secondaire porté par le carbone sub-terminal) et les fonctions portées par le carbone hémiacétalique. Dans ce dernier cas, il est nécessaire d'avoir quelques notions concernant l'anomérie (voir le paragraphe Anomérie).
Représentation de Haworth
Les quatre étapes permettant de passer, sans erreur, de la formule de Fischer du D-glucose linéaire à la représentation de Haworth du D-glucopyranose.
La solution donnée ici fonctionne quelle que soit la nature du cycle (furanose ou pyranose), la nature de l'ose (aldose ou cétose) et son appartenance à l'une ou l'autre des séries de Fischer (D ou L), à condition bien sûr que la cylisation n'utilise pas l'alcool primaire du carbone terminal !
Les cycles naturels sont des structures compactes.
Furanoses et pyranoses sont les structures cycliques les plus stables pour les oses, parce que les plus compactes. Les forces de dispersion de London et les contacts de Van der Waals stabilisent les structures dans lesquelles les atomes sont étroitement empaquetés. C'est l'une des raisons pour lesquelles l'existence de septanoses (cycles à 7 atomes = 6 carbones et un oxygène) est peu probable. L'introduction du septième élément élargit le cycle et fait apparaître un espace déstabilisant en son centre.
Complément : Observer
Observer un furanose et un pyranose en modèles compacts
Ces modèle vus de dessus montrent bien les contacts entre atomes et l'absence de cavité au centre des cycles.