Hémoglobines normales et hémoglobines mutantes
Chez l'homme adulte les hématies sont constituées, pour plus de 95% de leur poids sec, par des hémoglobines.
Il s'agit, pour environ 95%, d'hémoglobine A (Hb A), pour 2,5% d'hémoglobine A2 (Hb A2), et de traces d'hémoglobines F et de fractions résultant de modifications post-traductionnelles.
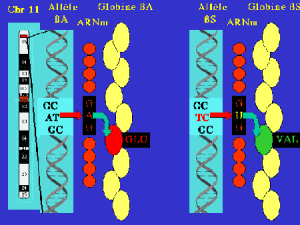
Les hémoglobines sont des molécules tétramériques (fig.1), de masse moléculaire de 65000 daltons. Chaque molécule est constituée, outre 4 groupes Hèmes, de deux chaînes polypeptidiques de type α et de deux chaînes de type non-α, dont la nature définit le type d'hémoglobine. L'hémoglobine A est ainsi constituée de deux chaînes α et de deux chaînes β, sa formule s'écrit α2β2.
L'hémoglobine A2 est constituée de deux chaînes α et deux chaînes δ, soit α2 δ2. Les chaînes α et β sont formées respectivement de 141 et 146 acides aminés.

Les chaînes sont codées par des gènes situés en deux locus proches sur le chromosome 16, et les chaînes β par les gènes situés en un locus sur le chromosome 11.
De nombreuses mutations sont connues pour les différents gènes α, β, δ dont plusieurs conduisent, à l'état homozygote, à des pathologies plus ou moins graves.
L'hémoglobine S (Hb S) est la forme anormale la plus fréquemment rencontrée. Elle doit son nom au fait qu'elle est responsable de la drépanocytose ou anémie falciforme (Sickle cell anemia des auteurs anglo-saxons).
La différence avec l'hémoglobine A provient du remplacement, en sixième position de la chaîne β, de l'acide glutamique habituel par une valine (figure 2).
Cette modification est due à une mutation dans le gène β. L'allèle normal sera noté \(\beta^{A}\) et l'allèle muté \(\beta^{S}\). La formule de l'hémoglobine S s'écrira donc \(\alpha2\beta^{S}2\).
On distingue deux formes cliniques selon que les individus sont homozygotes (\(\beta^{S}\)/\(\beta^{S}\)) ou hétérozygotes (\(\beta^{A}\)/\(\beta^{S}\)).
Les premiers souffrent d'une anémie hémolytique chronique grave et meurent généralement avant l'âge d'un an; les seconds sont au contraire le plus souvent en bonne santé.
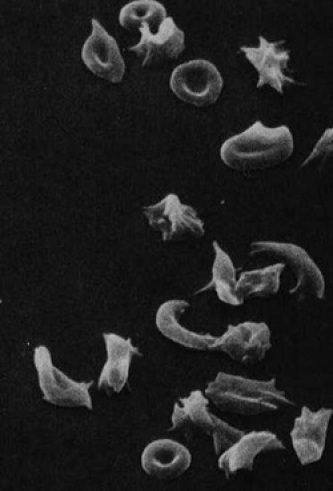
Chez les homozygotes, les globules rouges contiennent essentiellement de l'hémoglobine S. Ils prennent une forme de faucille (d'ou le nom de la maladie, fig.3) lorsque le sang est pauvre en oxygène (soit pour une pression partielle inférieure à un seuil de l'ordre de 50 à 60 mm de mercure).
L'HbS désoxygénée a une solubilité réduite ; elle forme des cristaux allongés à l'intérieur du globule, lui conférant cette forme en faucille. Les membranes cellulaires sont fragilisées, ce qui conduit à une destruction précoce des hématies. La modification de ces cellules se produit plus facilement dans les organes périphériques et provoque une augmentation de la viscosité du sang pouvant aboutir à des crises vasculaires très douloureuses, entraînant la lésion de divers organes. Chez les hétérozygotes, les globules rouges contiennent un mélange d'hémoglobine A et d'hémoglobine de type S ne conduisant pas, dans les conditions physiologiques habituelles, à la formation de cellules en faucille. Des dosages biologiques permettent cependant de différencier les individus homozygotes des hétérozygotes.
Question
Ces premières données permettent de supposer que les génotypes \(\beta^{A}\beta^{A}\) et \(\beta^{A}\beta^{S}\) sont également viables et les génotypes \(\beta^{S}\beta^{S}\) quasiment létaux.
En admettant qu'il en soit bien ainsi, quel devrait être l'ordre de grandeur de la fréquence de l'allèle \(\beta^{S}\) dans les populations humaines si la sélection était le seul facteur agissant sur ce caractère ?
Fréquence forte > 0,50
Fréquence modérée ~ 0,10
Fréquence très faible ~ 0,01
Réponse
Il s'agit bien de la réponse 3 !
Selon l'énoncé nous avons w1 = w2 et w3 = 0 et le modèle de base de la sélection indique que l'allèle létal tend à être éliminé. La fréquence doit donc être très faible dans les populations.