La biosynthèse des protéines : traduction d'un ARN messager en polypeptide
Le terme traduction désigne l'ensemble des mécanismes qui transforment l'information portée par la séquence d'un ARN messager en une séquence polypeptidique. Ainsi, le flux d'information va passer de la forme acide nucléique (alphabet à 4 lettres) à la forme protéine (alphabet à 20 lettres) selon un code "universel". Le code génétique permet d'attribuer une signification (acide aminé ou arrêt de traduction) à chaque triplet de bases nucléiques de l'ARNm.
Localisation de la biosynthèse des protéines
La synthèse des protéines a lieu dans le cytoplasme.
Chez les procaryotes, la transcription et la traduction sont couplées : les ARNm sont traduits en polypeptides au fur et à mesure de leur synthèse.
Par contre, chez les eucaryotes, l'ARN messager, transcrit et maturé dans le noyau, est transféré dans le cytoplasme avant d'être traduit.
La traduction se déroule au sein des ribosomes, complexes ribonucléiques, qui servent de support à l'assemblage ordonné des acides aminés du polypeptide codé par l'ARNm. Cette synthèse s'effectue en présence de différents types de facteurs protéiques. L'hydrolyse des nucléosides triphosphates, ATP ou GTP en nucléosides diphosphates, ADP ou GDP, fournit l'énergie nécessaire aux différentes étapes de la biosynthèse des protéines.
Les acteurs de la transmission du message génétique à travers la traduction du code
l'ARN messager (ARNm) porte la séquence informative, succession des codons spécifiant chaque acide aminé de la protéine ,
les ARN de transfert (ARNt) sont capables d'établir la correspondance entre un codon et un acide aminé précis. Les aminoacyl-ARNt synthétases assurent la fixation d'un acide aminé aux ARNt correspondants. Elles assurent la spécificité de la liaison entre un ARN de transfert donné et l'acide aminé correspondant.
Les principales étapes de la traduction
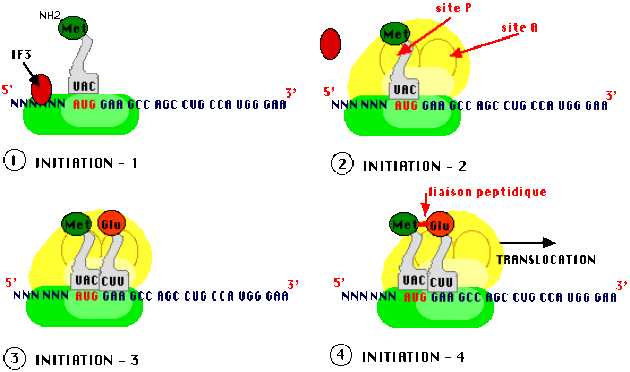
Démarrage ou initiation
Les deux sous-unités du ribosome sont indispensables à la traduction et vont se mettre en place au moment de la phase d'initiation de ce processus. Dans le cytoplasme, en absence de traduction, l'association d'une protéine supplémentaire, le "facteur d'initiation" IF3, avec la petite sous unité empêche l'assemblage spontané des ribosomes.
La petite sous-unité du ribosome reconnaît l'ARN messager et s'y fixe. Les modalités de la reconnaissance du site de démarrage de la traduction sur l'ARNm diffèrent chez les procaryotes et chez les eucaryotes :
Démarrage de la traduction chez les procaryotes | Démarrage de la traduction chez les eucaryotes |
Lien avec la transcription : La synthèse des protéines est ‘couplée à la synthèse de l'ARN messager. | Lien avec la transcription : Tous les ARN acteurs de la biosynthèse des protéines doivent migrer dans le cytoplasme, lieu de la synthèse des protéines. |
Site de fixation du ribosome sur l'ARNm : Séquence de Shine et Dalgarno, complémentaire d'une séquence portée par l'ARNt d'initiation. | Site de fixation du ribosome sur l'ARNm : Coiffe méthylée de l'ARNm, reconnue aux protéines fixatrices de la coiffe. Le ribosome glisse ensuite le long de l'ARNm jusqu'au premier codon AUG initiateur. |
Acide aminé chargé sur l'ARNi, un ARNt spécial pour l'initiation, associé à des facteurs d'initiation : formyl-méthionine ( fMet ) | Acide aminé chargé sur l'ARNi, un ARNt spécial pour l'initiation, associé à des facteurs d'initiation : méthionine ( Met ) |
La grande sous-unité vient compléter le ribosome, elle présente deux sites de reconnaissance et de traitement de chaque ARN de transfert chargé en acide aminé, les sites A et P qui permettent de recevoir des ARN de transfert avec un espacement correspondant exactement à deux triplets successifs.
Au départ, le site P (par lequel la Protéine naissante sort du complexe de traduction) ne peut être reconnu que par un ARN de transfert caractéristique de l'initiation (ARNti) systématiquement chargé en méthionine (chez les eucaryotes) ou en formyl-méthionine (chez les procaryotes). Cet ARN chargé est différent de celui qui sera utilisé en cours de synthèse pour apporter une méthionine là où le code le demande bien que le codon spécifiant la méthionine (A U G) soit unique, du fait des structures tertiaires de l'ARNt d'initiation (ARNtimet) et des autres. Des facteurs protéiques d'initiation (IF), formant un complexe avec l'ARNti chargé (en méthionine ou en formyl methionine) jouent un rôle essentiel dans la reconnaissance du site P.
Lorsque cet assemblage est effectué, un second ARNt chargé vient occuper le site A (sur lequel arrivent les Acides Aminés). La sélection de cet ARNt repose sur l'appariement codon-anticodon de telle sorte que l'acide aminé spécifié par le deuxième codon est en contact avec la méthionine d'initiation, une liaison peptidique peut s'établir entre les deux acides aminés. C'est une aminoacyl peptidyl-transférase qui catalyse l'établissement de cette liaison.
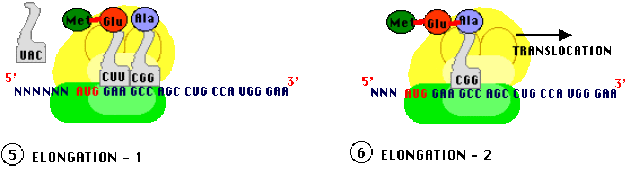
Allongement ou élongation
L'élongation nécessite la translocation du ribosome qui se décale exactement d'un triplet de nucléotides. Il en résulte que : le site P contient maintenant le second ARNt chargé s'un dipeptide et le site A est maintenant libre de recevoir un troisième ARNt chargé d'un troisième acide aminé (spécifié par le codon "en cours" face au site A) ce qui entraîne une deuxième liaison peptidique, les ARNt amont (côté site P) sont libérés. Ici encore, des facteurs protéiques, spécifiques de l'élongation (EF) forment des complexes avec les ARNt chargés pour assurer l'installation dans le site A. Les translocations du ribosome se poursuivent avec adjonction séquentielle d'acides aminés à la chaîne peptidique en cours jusqu'à la terminaison.
De nouveaux ribosomes démarrent de nouvelles séquences d'initiation - élongation... avant que les précédents aient terminé
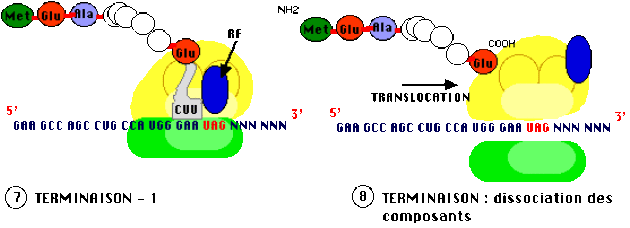
Arrêt ou terminaison
L'arrêt de la traduction est indiqué dans l'ARN messager par un des trois codons stop : UAG ou codon "ambre", UAA ou "ochre" et UGA ou "opale" (terminologie liée à l'historique de leur découverte). Aucun ARN de transfert ne possède d'anticodon correspondant à ces triplets 'non-sens', un facteur protéique de relargarge ("Release Factor" en anglais, d'où l'abréviation RF) vient occuper le site A, la translocation du ribosome s'arrête, la protéine est relachée ainsi que le dernier ARNt et les deux sous-inités du ribosome se séparent.