Mécanisme général de la photosynthèse
Expérience de RUBEN et KAMEN
\(CO_{2} ~(+H_{2}O) \xrightarrow[\begin{array} {c} \textrm{Cellule chlorophylienne} \\ \textrm{Chloroplaste} \end{array}] {\overset{\textrm{Lumi\`ere}}{\downarrow}} (CH_{2}O) + O_{2}\)
L'équation globale de la réaction photosynthétique ( voir ci-dessus ) ne nous permet pas de savoir d'où vient le dioxygène produit : du \(CO_{2}\) ou de \(H_{2}O\) ?
L'hypothèse que l'\(O_{2}\) dégagé provenait du \(CO_{2}\) est apparue longtemps comme la plus vraisemblable.
RUBEN et KAMEN ont alors imaginé de marquer les différents substrats possibles avec de l'oxygène lourd (\(~^{18}O\)).
Lorsque l'on marque l'oxygène de l'eau, le dioxygène produit lors de la photosynthèse est marqué.
\(2~H_{2}O \rightarrow ~O_{2}\) ; \(H_{2}\) n'étant pas marqué par l'oxygène lourd.
Cette expérience démontre que le dioxygène provient de l'eau et a plusieurs conséquences :
L'eau est impliquée directement dans les réaction chimiques de la photosynthèse.
Pour produire une molécule de dioxygène, il faut décomposer deux molécules d'eau.
On est donc amené à modifier la réaction globale de la manière suivante, en ce qui concerne la transformation de l'eau :
\(2~H_{2}O \xrightarrow[\textrm{Chloroplaste}] {\overset{\textrm{Lumi\`ere}}{\downarrow}} 4H + O_{2}\)
Nous obtenons ainsi globalement :
\(CO_{2} + 2~H_{2}O \xrightarrow[\begin{array} {c} \textrm{Cellule chlorophylienne} \\ \textrm{Chloroplaste} \end{array}] {\overset{\textrm{Lumi\`ere}}{\downarrow}} (CH_{2}O) + O_{2} + H_{2}O\)
On peut alors séparer la photosynthèse en deux réactions d'oxydoréduction :
l'une d'oxydation de l'eau ( \(H_{2}O \rightarrow O_{2}\) )
l'autre de réduction du \(CO_{2}\) (\(CO_{2} \rightarrow (CH_{2}O)\) )
Expériences de Hill
HILL, grâce à une série d'expériences a pu préciser les mécanismes sous-jacents à une oxydation de l'eau.
HILL utilise une suspension de chloroplastes isolés.
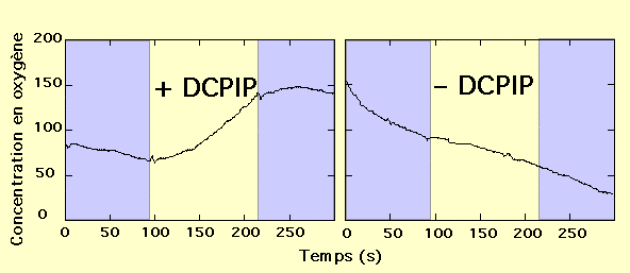
Il ajoute à cette préparation un corps oxydé susceptible d'exister à l'état réduit (dans son expérience historique, HILL utilisait le ferrocyanure de potassium, mais on peut utiliser expérimentalement d'autres substrats comme le DCPIP par exemple).
L'expérience est réalisée en l'absence de \(CO_ {2}\) en mesurant le dioxygène produit à l'aide de l'électrode à oxygène. La suspension de chloroplastes est soumise à une alternance obscurité / lumière / obscurité en l'absence de \(CO_{2}\).
Des chloroplastes isolés produisent du dioxygène à la lumière à condition qu'ils soient en présence de l'accepteur d'hydrogène.
La photosynthèse ne peut pas théoriquement fonctionner (puisqu'il n'y a pas de source de carbone) ; et pourtant, nous observons une production de dioxygène uniquement lorsque les chloroplastes sont incubés en présence de l'accepteur d'hydogène.
Dans le même temps, l'accepteur d'hydrogène oxydé passe à l'état réduit.
Cette expérience montre qu'en l'absence de \(CO_{2}\), l'oxydation de l'eau peut se réaliser s'il existe un accepteur d'H2 (\(H^{+} + e^{-}\)) ce que l'on peut schématiser de la manière suivante :
\(\underset{\textrm{DCPIP~ox}}{2~A + 2~H_{2}O} \xrightarrow[\textrm{Chloroplastes}]{\overset{\textrm{Lumi\`ere}}{\downarrow}} \underset{\textrm{DCPIP~r\'ed}}{2~AH_{2} + O_{2}}\)
La réaction d'oydation de l'eau peut donc être disjointe de la réaction de réduction du \(CO_{2}\).
Conclusion
La photosynthèse peut être disjointe en deux types de réactions :
Une réaction provoquée directement par la lumière (phase photochimique), utilisant l'eau comme substrat et produisant de l'énergie chimique ainsi que, en particulier, des accepteurs réduits.
Une phase d'incorporation du CO_{2} et de synthèse de molécules carbonées réduites (phase biochimique) qui utiliserait l'énergie produite par la phase photochimique.
\(CO_{2} + H_{2}O \xrightarrow[\textrm{Chloroplastes}]{\overset{\textrm{Lumi\`ere}}{\downarrow}} (CH_{2}O) + O_{2}\)
\(CO_{2} \xrightarrow[\textrm{R\'eduction}] {~} (CH_{2}O)\)
\(H_{2}O \xrightarrow[\textrm{oxydation}]{\overset{\textrm{Lumi\`ere}}{\downarrow}} O_{2}\)
Remarque : Les mécanismes de production et de transfert d'énergie sont détaillés dans le sous chapitre "Réactions photochimiques".