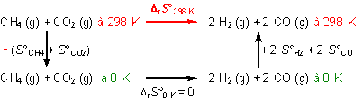Question 1
Énoncé
La réaction de reformage du méthane CH4 par le dioxyde de carbone CO2 s'écrit :
CH4 (g) + CO2 (g) \(\rightarrow\) 2 H2 (g) + 2 CO (g) (1)
Déterminer la valeur de l'entropie standard de réaction \(\Delta_rS°\) de (1) à 298 K et réfléchir aux raisons qui permettent de dire pourquoi cette valeur doit être positive. La réponse sera donnée en J.mol-1.K-1.
Données :
Entropies absolues standard S°298K (en J.mol-1.K-1) | |
|---|---|
CH4 (g) | 186,2 |
CO2 (g) | 213,6 |
CO (g) | 197,6 |
H2 (g) | 130,6 |
Aide simple :
L'entropie de réaction est reliée à l'état de désordre : elle est positive lorsque l'état de désordre augmente, ce qui est le cas pour cette réaction puisque \(\sum \nu_{i,gaz}\) > 0.
Rappel de cours :
On peut imaginer le cycle suivant :
Rappel : l'entropie est une fonction d'état lorsque l'on suit un chemin réversible.
On retrouve ainsi les entropies absolues des réactifs et des produits (flèches verticales) et les entropies standard de réaction.
A 0 K, les entropies standard sont nulles.
Résultat
Correction
Explications
Le cycle proposé dans l'aide méthodologique permet de retrouver la formule : \(\Delta_rS°_{298K} = \sum \nu_{i}S_i°\)
avec\(\nu_i\) algébrique (> 0 pour un produit, < 0 pour un réactif)
L'application de cette formule conduit à :
\(\Delta_rS°_{298K} = 2 S°_{H_2} + 2 S°_{CO} - S°_{CH_4} - S°_{CO_2} = (2 \times 130,6) + (2 \times 197,6) - 186,2 - 213,6\) = 256,6 J.mol-1.K-1.
Cette entropie de réaction est positive et importante car l'état de désordre du système augmente (la quantité de gaz croît avec l'avancement). Les coefficients stœchiométriques et les états physiques des espèces mises en jeu donnent généralement le signe et l'ordre de grandeur \(\Delta_rS°_T\).