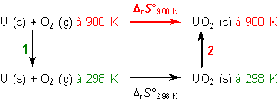Question 2
Énoncé
Déterminer l'entropie molaire standard de la réaction (en J mol-1.K-1) de formation du dioxyde d'uranium UO2 solide à 900 K et à pression constante : U (s) + O2 (g) \(\rightarrow\) UO2 (s)
et réfléchir aux raisons qui permettent de dire, sans faire de calcul, pourquoi cette valeur est négative.
S°298K (J.mol-1.K-1) | Cp (J.mol-1.K-1) | |
|---|---|---|
U (s) | 50,2 | 10,96 + 37,46.10-3T + 4,90.105 T-2 |
O2 (g) | 205 | 29,97 + 4,18.10-3T + 1,67.105 T-2 |
UO2 (s) | 77 | 63,6 |
Aide simple :
La dérivée par rapport à la température de l'entropie de réaction est reliée aux Cp et à la température par la relation :
\(\frac{d\Delta_rS}{dT}= \frac{\Delta_rCp}{T}\)
Rappel de cours :
L'intégration de la formule de l'aide conduit à un résultat que l'on peut obtenir à partir des transformations réversibles suivantes en exploitant le fait que l'entropie est, pour ce type de transformation, une fonction d'état :
Ainsi, \(\Delta_rS°_{900K}\) peut donc être obtenue en combinant \(\Delta_rS°_{298K}\) et les variations d'entropie dues aux modifications des températures des réactifs et des produits (flèches verticales 1 et 2).
Résultat
Correction
Explications
Le cycle de l'aide méthodologique ou l'intégration de la relation donnée dans l'aide permettent d'établir la formule suivante :
\(\Delta_rS°_{900K} = \Delta_rS°_{298K} +\displaystyle \int_{298K}^{900K} \frac{\Delta_rCp}{T} dT\)
(en sachant que \(\Delta_rS°_{298K} = \sum \nu_i S°_i\) et \(\Delta_rCp = \sum \nu_iP\), avec \(\nu_i\) algébrique : > 0 pour un produit ; < 0 pour un réactif)
On calcule les termes du membres de droite :
\(\Delta_rS°_{298K}= S°_{UO2(s)} - S°_{U(s)} - S°_{O2(g)}\) = 77 - 50,2 - 205 = - 178,2 J.mol–1.K–1.
\(\displaystyle \int_{298K}^{900K} \frac{\Delta_rCp}{T} dT = \displaystyle \int_{298K}^{900K} \frac{Cp_{UO_2(s)}-Cp_{O_2(g)}-Cp_{U(s)}}{T}dT = \int_{298K}^{900K} \left(\frac{63,6 - 29,97 - 10,96}{T} - 41,64.10^{-3} + \frac{(1,67 - 4,9) \times 10^5}{T^3}\right) dT = \bigg[22,67 \times lnT - 41,64.10^{-3}T - \frac{1,615 \times 10^5}{T^2} \bigg]_{298K}^{900K}\) = 1,6 J.mol-1.K-1
D'où : \(\Delta_rS°_{900K}\) = - 178, 2 +1,6 = - 176,6 J.mol-1.K-1.
Les entropies de réaction à 298 K et 900 K sont négatives car l'état de désordre du système diminue : les atomes du solide formé sont plus ordonnés que ceux du réactif gazeux.
En règle générale, l'entropie de réaction est négative pour un processus se ééroulant avec une diminution de la quantité de gaz.