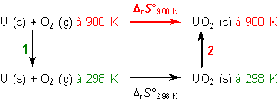Question 2
Déterminer l'entropie molaire standard de la réaction (en J mol-1.K-1) de formation du dioxyde d'uranium UO2 solide à 900 K et à pression constante : U (s) + O2 (g) \(\rightarrow\) UO2 (s)
et réfléchir aux raisons qui permettent de dire, sans faire de calcul, pourquoi cette valeur est négative.
S°298K (J.mol-1.K-1) | Cp (J.mol-1.K-1) | |
|---|---|---|
U (s) | 50,2 | 10,96 + 37,46.10-3T + 4,90.105 T-2 |
O2 (g) | 205 | 29,97 + 4,18.10-3T + 1,67.105 T-2 |
UO2 (s) | 77 | 63,6 |
Aide simple :
La dérivée par rapport à la température de l'entropie de réaction est reliée aux Cp et à la température par la relation :
\(\frac{d\Delta_rS}{dT}= \frac{\Delta_rCp}{T}\)
Rappel de cours :
L'intégration de la formule de l'aide conduit à un résultat que l'on peut obtenir à partir des transformations réversibles suivantes en exploitant le fait que l'entropie est, pour ce type de transformation, une fonction d'état :
Ainsi, \(\Delta_rS°_{900K}\) peut donc être obtenue en combinant \(\Delta_rS°_{298K}\) et les variations d'entropie dues aux modifications des températures des réactifs et des produits (flèches verticales 1 et 2).