Question 2
A 298 K, l'enthalpie libre molaire standard \(\Delta_rG°_{298K}\) de la réaction d'isomérisation :
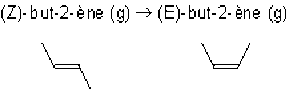
vaut 3,06 kJ.mol-1.
Déterminer la valeur de l'enthalpie libre molaire \(\Delta_rG°_{298K}\) du gaz obtenu en mélangeant 0,9 mol de l'isomère Z et 0,1 mol de l'isomère E sous une pression P égale à la pression standard P°. On supposera les gaz parfaits.
Donner la réponse en kJ.mol-1.
Donnée : R = 8,314 J.mol-1.K-1.
Aide simple :
Expliciter Q, quotient réactionnel (appelé aussi monôme des activités M), en fonction des activités aE et aZ des isomères du but-ène-2.
Rappel de cours :
La formule \(\Delta_rG_T = \Delta_rG°_T+ RTlnQ\) permet de déterminer l'enthalpie libre molaire d'une réaction :
à partir de sa valeur standard (\(\Delta_rG°_T\)) ;
des activités des espèces mises en présence.
Remarque : C'est en fait le signe de \(\Delta_rG_T\) et non sa valeur absolue qu'il est important de connaître.
Le signe - indique que, pour le mélange réactionnel choisi, le sens d'évolution possible pour la réaction (1) est celui de son écriture.