Hydrolyse de l'acétate d'éthyle par une solution de soude
Principe
En solution aqueuse basique, les ions hydroxyde OH- réagissent sur les esters. Lorsque l'ester est l'acétate d'éthyle, la réaction s'écrit
\(\mathbf{\textrm{CH}_3\textrm{COOC}_2\textrm H_5+\textrm{OH}^-\longrightarrow\textrm{CH}_3\textrm{COO}^-+\textrm C_2\textrm H_5\textrm{OH}}\)
Au cours de la réaction, les concentrations en ester et en ions \(\textrm{OH}^-\) diminuent, tandis celles en éthanol et en ions acétate \(\textrm{CH}_3\textrm{COO}^-\) augmentent. La concentration en ions sodium \(\textrm{Na}^+\), qui sont présents lorsque la base utilisée est la soude, reste inchangée (ions spectateurs). Les ions acétate \(\textrm{CH}_3\textrm{COO}^-\) remplacent progressivement les ions hydroxyde \(\textrm{OH}^-\). Comme ils se déplacent plus lentement dans l'eau que ces derniers, la résistance de la solution augmente avec l'avancement de la réaction. On peut donc suivre l'évolution de la composition du mélange réactionnel en mesurant sa résistance.
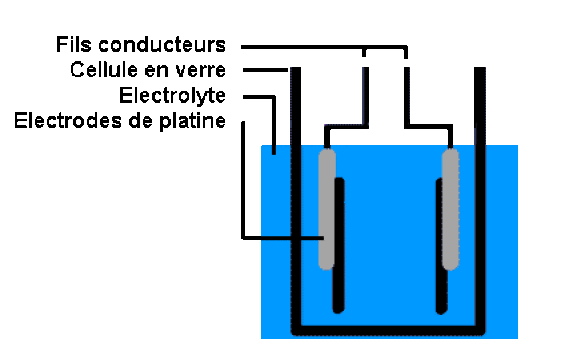
Cellule de mesure de la conductivité d'électrolytes liquides

Ce dispositif comprend 2 électrodes planes et parallèles de platine platiné.
Le conducteur électrolytique que l'on veut étudier occupe l'espace compris entre ces électrodes. Une armature en verre fixe la géométrie de l'ensemble, isole les faces externes des électrodes et soustrait les fils conducteurs de l'effet éventuellement corrosif des solutions.
Facteur géométrique de la cellule
La résistance \(R\) est reliée à la conductivité \(c\) de l'électrolyte et à la géométrie de la cellule par la relation : \(\mathbf{R=\frac{1}{\chi}\times\frac{d}{S}}\) .
\(d\) est la distance qui sépare les électrodes de surface \(S\). Le rapport \(\frac{d}{S}\) est le facteur géométrique ou constante de cellule. Ce rapport caractérise la cellule employée. Sa valeur s'obtient en mesurant la résistance \(R_\textrm{ étalon}\) d'une solution thermostatée dont la résistivité est tabulée. On utilise généralement des solutions de chlorure de potassium \(\textrm{KCl}\). Cet étalonnage est indispensable lorsque l'on veut faire des mesures précises de résistivités de solutions. De plus, la connaissance de la constante de cellule permet de régler de façon optimale les conditions de fonctionnement du conductimètre.
Conductimètre
Cet appareil, appelé aussi résistivimètre, affiche la valeur de la conductance \(C\) ou celle de la résistance \(R\) de l'électrolyte dans lequel est immergée la cellule. Cette mesure résulte de l'analyse de la réponse de la cellule à un signal d'entrée périodique. Les caractéristiques de ce signal dépendent de la gamme de mesure choisie et de la constante de cellule.
Après avoir précisé la valeur de la constante de cellule ( c ), on choisit le mode d'affichage ( a ) : résistance en \(\Omega\) ou conductance en Siemens S (1 S = 1 \(\Omega\) -1). On sélectionne ensuite la gamme de mesure appropriée ( b )
Réalisation de l'expérience
Au temps \(t = 0\), on mélange rapidement et sous agitation, des volumes égaux (100 mL) de solutions aqueuses d'ester 0,1 mol.L-1 et de soude 0,1 mol.L-1 . Simultanément, on déclenche le chronomètre.
La température initiale de ces solutions est la température ambiante. La cellule de mesure de la conductivité et un thermomètre (pour contrôler la constance de la température en cours d'expérience) sont immergés dans ce mélange. Les réglages du conductimètre ont été préalablement effectués.
On relève ensuite à intervalles de temps réguliers, la valeur de la résistance \(R_t\) de la solution en cours d'évolution.
Comme la réaction d'hydrolyse est équilibrée, les mesures ne sont effectuées que pendant une dizaine de minutes. Dans ces conditions, les résultats des mesures expérimentales peuvent être exploités sans difficulté en raison de la forme simplifiée que prend la loi de vitesse : le terme correspondant à la réaction se déroulant dans le sens de la formation de l'ester peut alors être négligé.
En fin d'expérience, on mesure également les valeurs des résistances de solutions aqueuses de soude 0,05 mol.L-1 (\(R_0 = 122 \Omega\) ) et d'acétate de sodium 0,05 mol.L-1 (\(R_\textrm{NaOAc} = 347 \Omega\) ) qui correspondent respectivement à la solution initiale et à la solution que l'on obtiendrait si la réaction était totale.
Simulation de la manipulation
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
