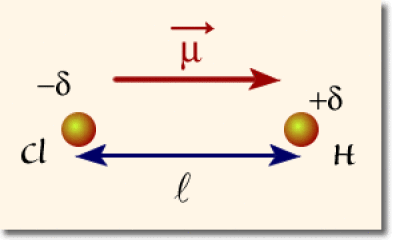
Moment dipolaire
L'état de polarisation d'une liaison est caractérisé par son moment dipolaire \(\stackrel{\to}{\mu}\). Le moment dipolaire est une grandeur vectorielle. Il est orienté du pôle négatif vers le pôle positif.
Remarque :
La convention encore très répandue en chimie est l'orientation inverse, mais elle ne doit plus être utilisée.
Dans une unité spécifique appelée le Debye (symbole \(\textrm D\)), le module noté \(\mu\) de ce vecteur est relié à la longueur de liaison \(l\) et à la charge partielle\( \delta\) :
\(\mu=\textrm{4,8}.l.\delta\)
Dans cette formule, \(\mu\) est en Debye, \(l\) est en \(\AA\) , \(\delta\) est sans unité. La conversion en unité S.I. (Système International) - le Coulomb.mètre - est donnée par :
\(1 \textrm D=\textrm{3,33}.10^{-30} \textrm{C.m}\)
Exemple :
Le moment dipolaire mesuré de la molécule \(\textrm{HCl}\) est \(\mu = \textrm{1,07 D}\). Sachant que la longueur de la liaison vaut 0,136 Angström, la charge partielle calculée vaut alors 0,16.