2 ème cas de figure
La symétrie adoptée dépend de la nature des espèces mises en jeu.
Influence de la nature du ligand
Considérons le cas du même ion de transition, par exemple l'ion nickel(II) avec des ligands différents \(\mathbf{\textrm{Cl}^-}\) et \(\mathbf{\textrm{CN}^-}\).
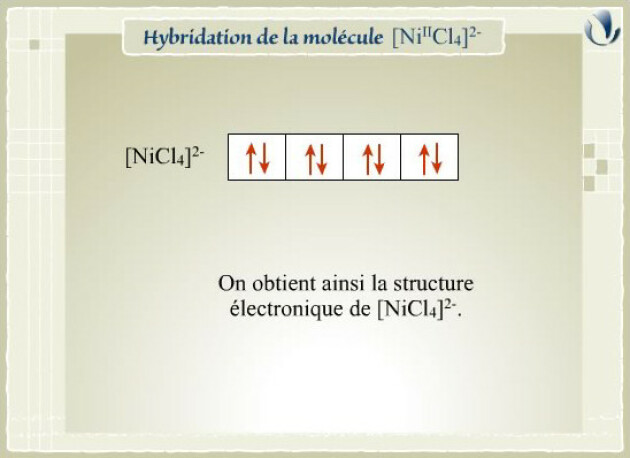
La structure du complexe \([\textrm{Ni}^\textrm{II}\textrm{Cl}_4]^{2-}\) est tétraédrique ; alors que celle de \([\textrm{Ni}^\textrm{II}\textrm{CN}_4]^{2-}\) est plan carré.
Influence de la nature du métal
Considérons maintenant le cas de deux ions de transition différents mais appartenant à la même colonne du Tableau Périodique entourés d'un même ligand : \([\textrm{Ni}^\textrm{II}\textrm{Cl}_4]^{2-}\) et \([\textrm{Pt}^\textrm{II}\textrm{Cl}_4]^{2-}\).
La structure de \([\textrm{Ni}^\textrm{II}\textrm{Cl}_4]^{2-}\) est tétraédrique. Ce complexe se forme à partir de l'ion \(\textrm{Ni}(\textrm{II})\) dans l'état d'hybridation \(sp^3\).
En revanche, le complexe \([\textrm{Pt}^\textrm{II}\textrm{Cl}_4]^{2-}\) adopte une structure Plan Carré.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Cette structure se forme à partir des orbitales du platine dans un état d'hybridation \(\textrm{dsp}^2\). L'hybridation (\(\textrm{dsp}^2\)) des orbitales du platine implique une orbitale \(\textrm d\) vacante qui s'associera avec un doublet non liant du \(\textrm{Cl}^-\).
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.