Le dioxyde d'azote et ses dérivés
Structure

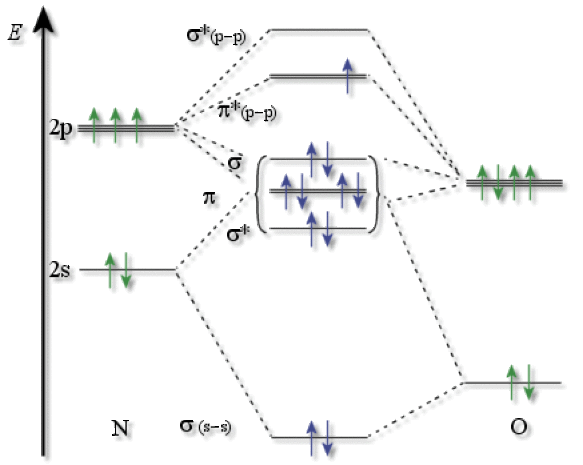
C'est une molécule coudée, paramagnétique, avec 1 électron antiliant sur l'OMHO (comme \(\textrm{NO}\)).
Rappel : Diagramme OM du monoxyde d'azote
Préparation
On l'obtient par oxydation spontanée de \(\textrm{NO}\).
Il est également produit lors de la décomposition des nitrates.
Rappel : Oxydation du monoxyde d'azote
\(\textrm{NO}\) est directement oxydable à froid par le dioxygène :
\(\textrm{NO (g)}+\frac{1}{2}.\textrm O_2 \textrm{(g)}\to\textrm{NO}_2 \textrm{(g)}\textrm{ }\textrm{ }\)(complète pour \(T<150 °\textrm C\))
Propriétés
Il a une couleur brun-rouge caractéristique.
C'est un gaz à 25 °C, \(T_{eb}=20 °\textrm C\) soit \(293 \textrm K\).
Peu stable, il redonne \(\textrm{NO}\) à 600 °C (d'où l'appellation «\(\textrm{NO}_\textrm x\) » car on a souvent affaire à des mélanges \(\textrm{NO}/\textrm{NO}_2\)).
Il peut se dimériser réversiblement en \(\textrm N_2\textrm O_4\) qui est diamagnétique, et qui comporte une liaison \(\textrm N-\textrm N\) très longue, donc fragile.
A l'état liquide ou en solution dans l'eau, il se dissocie en ions :
\(\mathrm{N_2O_4}\leftrightarrow\mathrm{NO_2^++NO_2^-~~(\textrm{nitryle~et~nitrite)}}\)
\(\mathrm{N_2O_4}\leftrightarrow\mathrm{NO^++NO_3^-~~(\textrm{nitrosyle~et~nitrate)}}\)\(\)
L'ion nitryle \(\textrm{NO}^+_2\) est isoélectronique de \(\textrm{CO}_2\) (donc bien stable, linéaire) : \(\textrm{NO}_2\) est donc réducteur comme \(\textrm{NO}\).
L'hydrolyse de \(\textrm{NO}_2\) amène à la formation d'acide nitrique, c'est une étape-clé du cycle industriel de l'azote. Plusieurs réactions ont lieu en même temps :
\(2.\textrm{NO}_2+\textrm H_2\textrm O\leftrightarrow\textrm{HNO}_2+\textrm{HNO}_3\) (hydrolyse de \(\textrm{NO}_2\))
\(3.\textrm{HNO}_2\leftrightarrow\textrm{HNO}_3+2.\textrm{NO}+\textrm H_2\textrm O\) (dismutation de \(\textrm{HNO}_2\))
\(\textrm{NO}+\frac{1}{2}.\textrm O_2\leftrightarrow \textrm{NO}_2\) (oxydation de \(\textrm{NO}\))
Il provoque les mêmes problèmes de pollution que NO.
Rappel : Pollution par Nox
\(\textrm{NO}\) a trois effets perturbateurs sur l'environnement :
Il provoque une eutrophisation (augmentation de la croissance des plantes), car les plantes l'assimilent facilement.
Il réagit avec l'ozone pour former du dioxygène : ceci permet de limiter la concentration en « mauvais » ozone au cœur des zones industrielles (effet plutôt bénéfique), mais par contre il contribue à attaquer le « bon » ozone stratosphérique (diminution de la protection contre les UV durs interstellaires).
Il provoque des pluies acides, car la réaction de \(\textrm{NO}_2\) avec l'eau atmosphérique amène à la formation d'acide nitreux \(\textrm{HNO}_2\) et nitrique \(\textrm{HNO}_3\):
\(\textrm{NO (g)}+\frac{1}{2}.\textrm O_2 \textrm{(g)}\to \textrm{NO}_2 \textrm{(g)}\)
\(2.\textrm{NO}_2+\textrm H_2\textrm O\to \textrm{HNO}_2+\textrm{HNO}_3\)