Propriétés oxydantes
Le dichlore est un oxydant très puissant.
Le gaz dichlore se dissout dans l'eau suivant la réaction :
\(\textrm{Cl}_2\textrm{ (g)}+\textrm H_2\textrm O \leftrightarrows \textrm{Cl}_2\textrm{ (aq)}\)
Une fois dissout dans l'eau, le dichlore et l'ion chlorure \(\textrm{Cl}^-\) forment un couple oxydo-réducteur qui possède un potentiel rédox élevé.
\(\textrm{Cl}_2\textrm{ (aq)}+2.\textrm e^-\leftrightarrows 2.\textrm{Cl}^-\textrm{ (aq)}\textrm{ }\textrm{ }E°=1\textrm,39 \textrm V\)
Attention :
Une partie de l'énergie correspondant à cette réaction est liée à la solvatation de \(\textrm{Cl}^-\) par l'eau, qui est très importante.
Ce potentiel élevé justifie son utilisation importante comme désinfectant, car il tue les bactéries en oxydant leur paroi bactérienne.
Réaction avec le dihydrogène
Cette réaction fortement exothermique correspond à la synthèse directe du chlorure d'hydrogène \(\textrm{HCl}\) :
\(\frac{1}{2}.\textrm H_2\textrm{ (g)}+\frac{1}{2}.\textrm{Cl}_2\textrm{ (g)}\leftrightarrows \textrm{HCl (g)}\textrm{ }\textrm{ }\Delta_\textrm rH^{\circ}=-184\textrm,6 \textrm{kJ.mol}^{-1}\)
Attention :
Le composé à l'état gazeux est appelé chlorure d'hydrogène, tandis qu'après dissolution dans l'eau on parle d'acide chlorhydrique !
8 % de la production mondiale de \(\textrm{HCl}\) est réalisée ainsi, dans un brûleur en silice ou en graphite. Le chlorure synthétisé est immédiatement mis en solution aqueuse (acide chlorhydrique), comme indiqué sur le schéma ci-dessous.
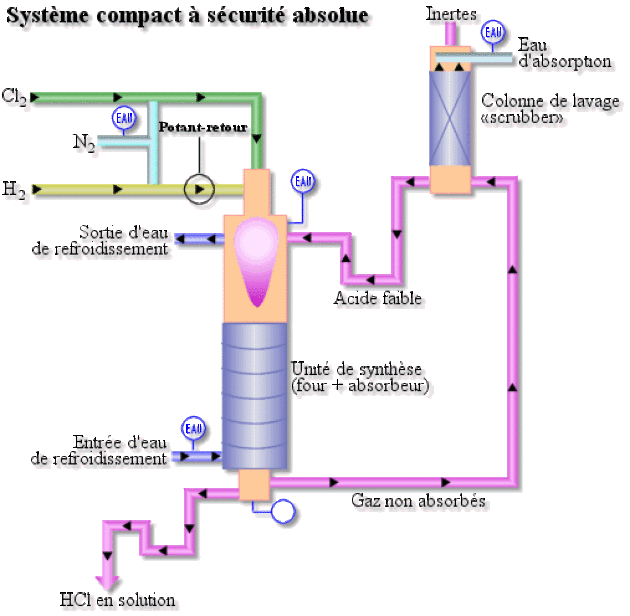
Réactions avec les halogénures
Le brome est fabriqué industriellement par oxydation de bromures (brome sous forme d'anion \(\textrm{Br}^-\)).
\(2.\textrm{Br}^-+\textrm{Cl}_2\textrm{ (g)}\to2.\textrm{Cl}^-+\textrm{Br}_2\textrm{ (l)}\)
La même réaction est possible pour les iodures (mais on ne l'utilise pas pour la synthèse de diiode), par contre elle est impossible pour les fluorures.
Ceci s'explique par l'évolution des propriétés des halogènes (électronégativité, caractère oxydant).
Remarque : Evolutions des halogènes
L'électronégativité des halogènes diminue avec leur numéro atomique \(Z\) : le fluor est plus électronégatif que le chlore, donc \(\textrm{Cl}_2\) ne peut pas oxyder \(\textrm F^-\) en \(\textrm F_2\).
Réactions avec les métaux
\(\textrm{Cl}_2\) étant un oxydant fort, les métaux brûlent dans ce gaz pour donner des chlorures supérieurs.
Remarque :
\(\textrm{MCl}_n\) dans lequel \(n\) est le plus élevé possible est un chlorure supérieur ou perchlorure.
Exemple :
\(\textrm{Al}\stackrel{\textrm{Cl}_2}{ \longrightarrow} \textrm{AlCl}_3\textrm{ (g)}\)
\(\textrm{Fe}\stackrel{\textrm{Cl}_2}{ \longrightarrow} \textrm{FeCl}_3\textrm{ (g)}\)
Cette réaction se produit également avec des métaux nobles : l'or (\(\textrm{AuCl}_3\)) et l'argent (\(\textrm{AgCl}_3\)).
Notons que les chlorures métalliques ont des propriétés très intéressantes en chimie industrielle : \(\textrm{AlCl}_3\) est un réactif important de la chimie organique (acylation de Friedel-Crafts), et \(\textrm{FeCl}_3\) est utilisé en solution aqueuse pour dissoudre le cuivre.
Carbochloration des oxydes
La voie directe mentionnée ci-dessus n'est pas toujours celle que l'on pratique industriellement, car on ne dispose au départ que des oxydes correspondants. On utilise alors un mélange carbone - dichlore, le carbone permettant de capter l'oxygène :
Exemple :
\(\textrm{SiO}_2\textrm{ (s)}+2.\textrm{C (s)}+2.\textrm{Cl}_2\textrm{ (g)}\stackrel{\textrm{HT}}{ \longrightarrow}\textrm{SiCl}_4\textrm{ (g)}+2.\textrm{CO (g)}\)
\(\textrm{Al}_2\textrm O_2\textrm{ (s)}+3.\textrm{C (s)}+3.\textrm{Cl}_2\textrm{ (g)}\stackrel{\textrm{HT}}{ \longrightarrow}2.\textrm{AlCl}_3\textrm{ (g)}+3.\textrm{CO (g)}\)
Ceci est mis en pratique pour l'obtention industrielle du titane et du zirconium. Dans le cas du zirconium le minerai généralement utilisé est \(\textrm{ZrSiO}_4\). En plus du silicium il existe en faible quantité du hafnium (\(\textrm{Hf}\)) qu'il est difficile de séparer du zirconium.
En traitant le minerai par carbochloration on obtient :
\(\textrm{ZrCl}_4\), \(\textrm{SiCl}_4\) et \(\textrm{HfCl}_4\)
On peut séparer ces trois produits par condensation fractionnée et distillation extractive. Le zirconium est obtenu en faisant réagir du magnésium sur son chlorure par le procédé Kroll, qui est une réduction par le magnésium métal :
\(\textrm{MCl}_4+2.\textrm{Mg}\to\textrm M+2.\textrm{MgCl}_2\textrm{ }\textrm{ }\textrm{(M=Ti, Zr, Hf, etc)}\)
Ainsi, grâce à l'ensemble de ces procédés, il est possible d'obtenir des métaux de grande pureté.