Différentes valeurs
Le couplage 1J
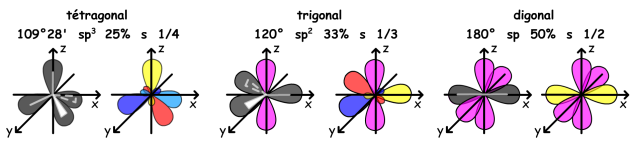
Une seule liaison sépare les deux noyaux. Il est principalement rencontré dans le cas de couplages hétéronucléaires et observé par exemple dans le cas des couplages \(\textrm{}^{13}\textrm{C-H}\) ou \(\textrm{}^{31}\textrm{P-H}\). Comme vous le savez, la liaison covalente \(\textrm{C-H}\) s'établit avec l'orbitale 1s de l'atome d'hydrogène et une orbitale hybride de l'atome de carbone. On appelle caractère s de l'orbitale hybride le coefficient relatif à l'orbitale s dans l'orbitale hybride.
L'augmentation de la valeur du couplage suit l'augmentation de la valeur du caractère s de l'hybridation du carbone, c'est-à-dire le pourcentage d'orbitale s participant à la liaison sigma. Ainsi, le couplage est d'autant plus fort que le relais électronique repose sur la participation d'orbitales s, les seules qui ont une densité non nulle au niveau du noyau.
Le couplage géminé 2J
Deux liaisons séparent les deux noyaux. Le couplage homonucléaire \(\textrm{}^2J\) ou couplage géminé, concerne deux atomes d'hydrogène portés par un même atome de carbone. Cette situation est celle des groupements méthylènes \(\textrm{-CH}_2\textrm-\) et méthyle \(\textrm{-CH}_3\). Ce couplage n'est pas systématiquement observé. Pour qu'il soit observé, il est nécessaire que les noyaux concernés ne soient pas isochrones. Comme dans le cas d'un méthyle \(\textrm{-CH}_3\), les trois protons sont toujours équivalents, on n'observera jamais ce couplage géminé pour les méthyles.
L'observation d'un couplage géminé est une preuve de non isochronie pour les deux protons d'un méthylène >CH2. Ce couplage révèle des aspects intéressants d'asymétrie de la molécule. Le couplage \(\textrm{}^2J\) n'est observé que dans le cas de non-équivalencee chimique (géométrie de la molécule) ou magnétique des protons d'un \(\textrm{-CH}_2\textrm-\).
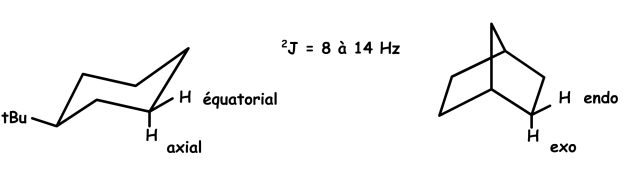
Exemple, si l'interconversion est bloquée (dans le tertiobutyl cyclohexane) ou dans le camphre.
Dans ces deux cas, on observera un couplage géminé \(\textrm{-CH}_2\textrm-\).
Le couplage géminé révèle des aspects intéressants d'asymétrie de molécule. C'est ce que l'on observe pour les deux protons \(\textrm{-CH}_2\textrm-\) d'un méthylène situé en position alpha d'un carbone asymétrique. Ces deux protons ne sont pas équivalents. Ils voient un environnement différent.
Leur signal se présente en général sous forme d'un signal AB (\(J_{AB}\) étant le couplage \(\textrm{}^2J\) géminé) plus ou moins découplé en fonction du nombre de protons portés par les carbones voisins. Dans ce composé, les deux protons du groupe méthylène >CH2 ne sont pas isochrones. Ils voient des environnements différents et par suite présentent des déplacements chimiques distincts. Ils sortent sous forme d'un signal AB, le couplage \(J_{AB}\) correspondant à un couplage \(\textrm{}^2J\) géminé de l'ordre de 10 hertz dans cet exemple.
Il faut noter que les valeurs des couplages géminés \(\textrm{}^2J\) sont très dépendantes de la valeur de l'angle \(\textrm{H-C-H}\). Pour des angles de 105 à 109° et dans le cas général des carbones hybridés \(sp^3\) (tétragonal) pour lesquels on a un angle de 109°28', on a des valeurs de couplage qui varient entre 10 et 20 Hz. Par contre, pour des angles de 120°, ce qui correspond par exemple à un carbone hybridé \(sp^2\) (trigonal), la valeur du couplage \(\textrm{}^2J\) devient faible et on observe des valeurs de couplage de 0 à 3 Hz.
Les valeurs des couplages \(\textrm{}^2J\) sont également dépendantes de l'électronégativité des substituants et de tout effet sur la densité électronique résultant d'atomes voisins. Cette dépendance traduit bien le rôle déterminant des électrons dans la transmission des couplages.
Le couplage vicinal 3J
Trois liaisons séparent les deux noyaux. Le couplage homonucléaire \(\textrm{}^3J\) ou couplage vicinal, concerne deux atomes d'hydrogène portés par deux atomes de carbone liés entre eux. Ce couplage a certainement fait le succès de la RMN du proton !
En effet, dans la mesure où ce couplage associe deux hydrogènes non isochrones, portés par deux carbones adjacents \(\textrm {H-C-C-H}\), il permet de construire des enchaînements carbonés. Il faut retenir que si les déplacements chimiques permettent d'identifier les différents groupes de protons en fonction de leurs environnements, l'examen des couplages vicinaux permet d'associer ces différents fragments les uns aux autres en fonction des multiplicités observées et des valeurs des constantes de couplages. L'examen des couplages vicinaux permet donc de construire les enchaînements du squelette protoné de la molécule.
Sa valeur est sensible à de nombreux paramètres. Ces facteurs :
les angles \(\textrm{H-C-C}\) et \(\textrm{C-C-H}\),
l'électronégativité des substituants,
les différents effets qui affectent la densité électronique des atomes, jouent un rôle important dans la valeur du couplage.
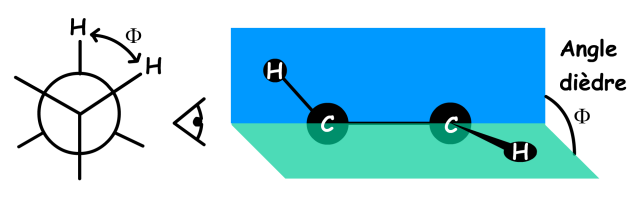
Un autre facteur joue un rôle dans la variation de la valeur du \(\textrm{}^3J\), c'est l'angle dièdre formé par les plans \(\textrm{H-C-C}\) et \(\textrm{C-C-H}\).
Cette dépendance de la valeur du couplage \(\textrm{}^3J\) avec l'angle \(\Phi\) (phi) est connue sous le nom de loi de KARPLUS. Nous allons voir cette variation de la valeur du couplage en fonction de l'angle dièdre \(\Phi\).
Pour :
un même environnement chimique,
une même hybridation des carbones,
de mêmes angles plans,
des substituants identiques, la valeur du couplage \(\textrm{}^3J\) obéit à une loi de variation de la forme suivante pour des éthanes.
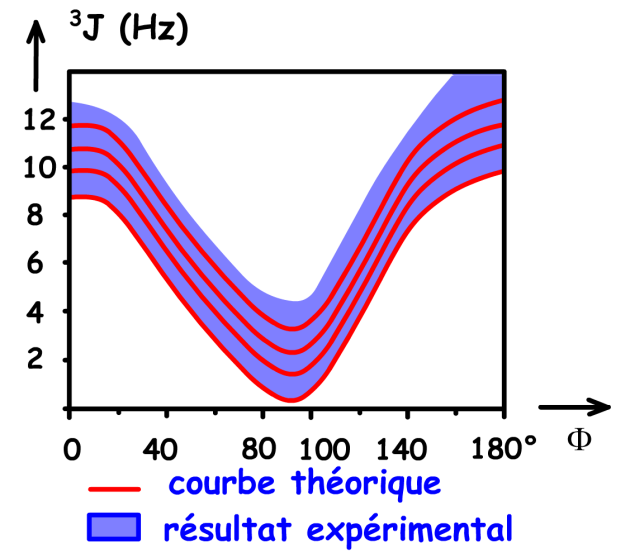
Pour une série de composés donnés, on peut tirer les conclusions suivantes :
les plus fortes valeurs du couplage \(\textrm{}^3J\) sont observées pour les situations dans lesquelles les quatre atomes \(\textrm{H-C-C-H}\) sont dans un même plan ( \(\Phi\)= 0°) ou voisins d'un même plan.
la valeur du couplage \(\textrm{}^3J\) la plus forte est toujours associée à la position antipériplanaire ( \(\Phi\)= 180°).
les valeurs des couplages \(\textrm{}^3J\) sont très faibles, voire nulles quand l'angle dièdre \(\Phi\) est voisin de 90°.
Exemple :
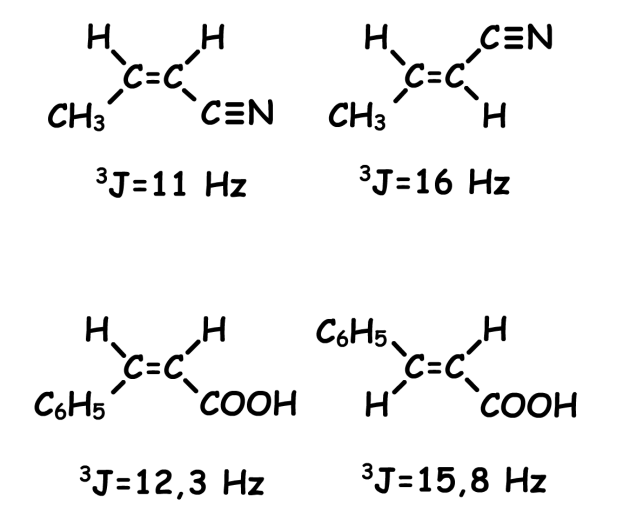
C'est ainsi que dans les alcènes, la valeur du couplage des protons qui se trouvent en position relative trans (alcène de configuration E) est toujours supérieure à la valeur du couplage des protons qui sont en position relative cis (alcène de configuration Z).
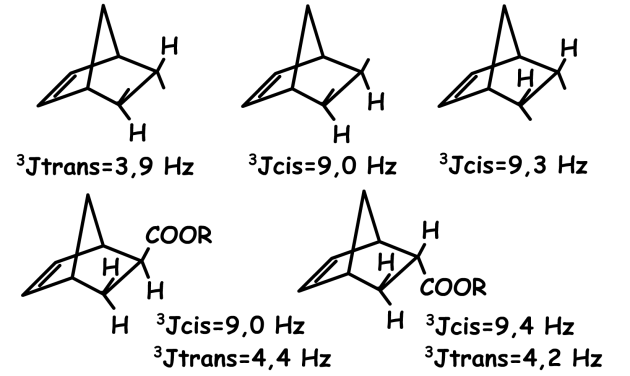
Pour des composés bicycliques, la valeur du couplage des protons en position cis est supérieure à la valeur du couplage des protons en position trans.
Ceci s'explique en considérant l'angle dièdre \(\Phi\).
Pour les protons en position cis, \(\Phi\)= 0°, les quatre atomes sont dans un même plan ( \(\textrm{}^3J\) = 9.0 Hz) alors qu'en position trans, l'angle \(\Phi\) est de l'ordre de 130° d'où \(\textrm{}^3J\) à peu près égal à 4 Hz.
Le couplage à longue distance 4J
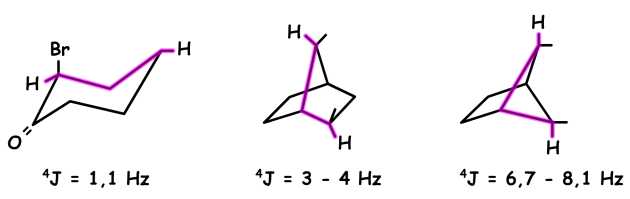
Quatre liaisons séparent les deux noyaux. Le couplage homonucléaire \(\textrm{}^4J\) ou couplage à longue distance, concerne deux atomes d'hydrogène portés par deux atomes de carbone liés à un autre atome de carbone : \(\textrm{H-C-C-C-H}\).
Ces couplages sont généralement inférieurs à 0.5 Hz et non décelables. Ils ne sont en fait décelables que dans des situations exceptionnelles. Par exemple, dans le cas d'une géométrie favorable dite en W (ou M), c'est-à-dire pour des fragments \(\textrm{H-C-C-C-H}\) en zigzag :
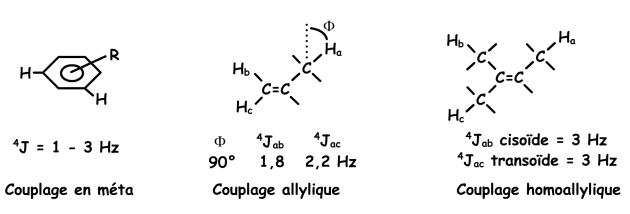
Ou encore, dans le cas de systèmes insaturés. La transmission du couplage est alors favorisée par la présence d'électrons délocalisés.