Les séries du spectre d'émission
Pour identifier les niveaux initial et final d'une transition d'émission, on leur affecte les nombres quantiques \(\mathrm{n_i}\) et \(\mathrm{n_f}\) respectivement (au lieu des symboles \(\textrm n\) et \(\textrm m\) utilisés précédemment).
Dans une transition d'émission, on a : \(\mathrm{n_i > n_f}\).
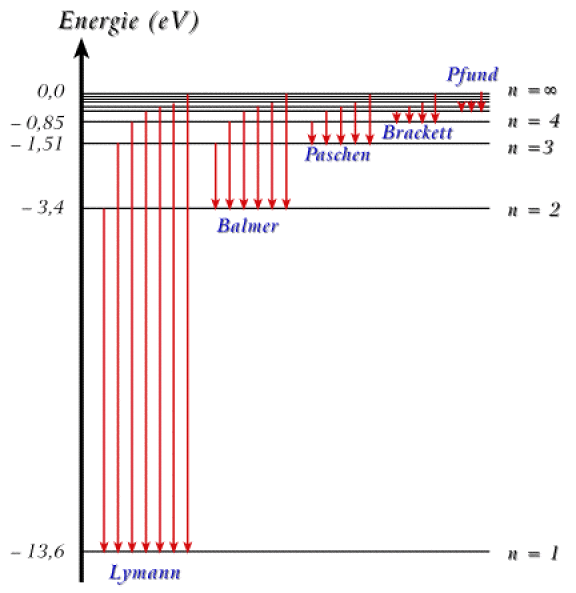
Les transitions sont classées en séries suivant le niveau final du processus d'émission. Ces séries portent le nom de leur premier observateur.
Historiquement, la première série observée le fut par Balmer dans le domaine du visible ; c'est en fait la seconde série car elle converge vers le second niveau. Le nombre d'onde du photon émis suit la loi de Ritz avec \(\mathrm{n_f = 2}\) pour la série de Balmer :
\(\mathbf{\overline\nu_{n_i\to n_f}=\textrm R_\textrm H.Z^2.\bigg(\frac{1}{n_f^2}-\frac{1}{n_i^2}\bigg)}\)
Une représentation du spectre des niveaux électroniques de l'hydrogène est donnée sur la figure suivante. Les transitions électroniques correspondant aux séries de Lyman, Balmer, Paschen Brackett et Pfund y sont également représentées.