Mécanisme
Le motif d'interaction révèle que l'hydrogène est toujours positionné entre deux atomes électronégatifs de petite taille ( \(\textrm N\), \(\textrm O\), \(\textrm F\)). Les distances caractéristiques sont très courtes. Les interactions électrostatiques sont alors plus fortes que pour les forces intermoléculaires "classiques" car elles mettent en jeu des pôles et multipôles petits et intenses.
L'existence d'une liaison covalente entre l'hydrogène et un atome électronégatif est aussi d'une importance prépondérante : cette liaison est polarisée, c'est à dire que la densité du nuage électronique est déplacée vers l'atome électronégatif. Il y a déplétion de la densité sur l'hydrogène au profit de l'atome électronégatif, comme représenté sur la figure ci-contre.
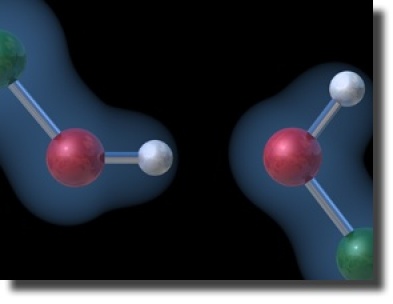
Motif d'interaction d'une liaison hydrogène
Le déficit en électron sur l'hydrogène diminue alors fortement l'écrantage de son noyau. L'autre atome électronégatif participant à la liaison hydrogène est aussi riche en électrons, qui sont attirés par le proton faiblement écranté de l'hydrogène.
La proximité des atomes fait que les modèles électrostatiques classiques de charges ponctuelles sont insuffisant pour décrire correctement ce type d'interaction. Il faut tenir compte de la nature quantique du nuage électronique et des recouvrements partiels des nuages des deux espèces liées. En ce sens, la liaison hydrogène possède un certain caractère covalent.
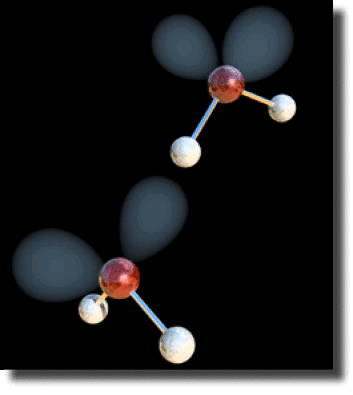
Interaction dirigée entre deux molécules d'eau
On peut alors mettre en évidence un caractère dirigé des interactions, mettant en jeu les paires libres des atomes électronégatifs. Sur la figure ci-contre on a représenté deux molécules d'eau en interaction. Chaque atome d'oxygène porte deux paires libres représentées par des orbitales hybrides de type \(\textrm{sp}^3\). Un hydrogène de la molécule au second plan se positionne suivant l'axe d'hybridation.
Cet aspect dirigé des interactions se traduit par exemple dans l'arrangement des molécules d'eau à l'état cristallin. Leur orientation est caractéristique de l'hybridation sp3. Voir les animations ci-dessous.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.