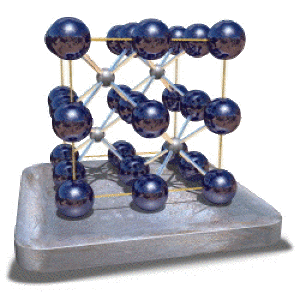
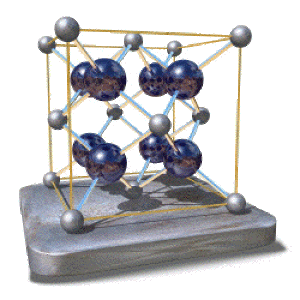
La fluorine
Dans le fluorure de calcium \(\textrm{CaF}_2\), les ions fluor (représentés ci-contre en bleu) occupent les sommets, les centres des faces, les milieux des arêtes et le centre de la maille. Les ions calcium (en gris) occupent la moitié des sites cubiques. Ils ont donc une coordinence 8. Chaque fluor est entouré par quatre atomes de calcium qui forment un tétraèdre (coordinence 4). La maille contient quatre groupements \(\textrm{CaF}_2\).
La structure ci-contre est appelée fluorine.
On peut représenter alternativement cette structure en plaçant les ions calcium dans un réseau cfc et les ions fluors au centre de tous les sites tétraédriques, comme illustré ci-contre. Cette représentation met en évidence la symétrie cubique faces centrées mais illustre mal la compacité du réseau des ions fluor ; elle est par contre plus adaptée à la description de composés tels que \(\textrm{Li}_2\textrm O\).
On l'appelle structure antifluorine.