Critères de coordinence
On a vu dans les métaux que les empilements compacts de type h.c. ou c.f.c. assurent une compacité et donc une cohésion maximale.
Dans les cristaux ioniques, formés d'éléments différents, de type anion ou cation, le rapport des rayons ioniques est un critère déterminant pour le type d'empilement. Il détermine la coordinence de chaque élément.
Le tableau ci-dessous donne le type de coordinence en fonction du rapport des rayons des cations et des anions composant un cristal binaire, c'est-à-dire composé de deux éléments.
Rapport \(\mathrm{\frac{R_{cation}}{R_{anion}}}\) | 0,732 | 0,414 | 0,225 | 0,155 |
Coordinence | 8 | 6 | 4 | 3 |
Arrangement | cube | octaèdre | tétraèdre | triangle équilatéral |
Les valeurs numériques portées dans ce tableau correspondent à des structures "idéales" dans lesquelles tous les ions sont tangents.
Dans une structure de type \(\textrm{NaCl}\) par exemple, dans laquelle les ions sont en environnement octaédrique (coordinence 6), le rapport des rayons ioniques est tel que les ions sont tous tangents sur une face.

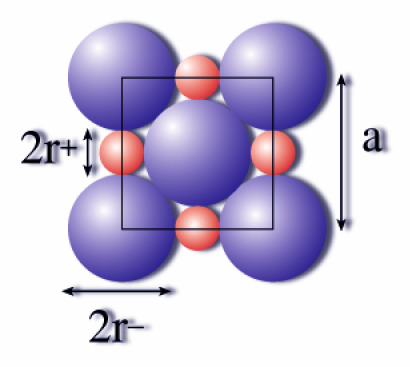
Un calcul simple permet d'obtenir ce rapport "critique" des rayons ioniques :
\(\frac{r^+}{r^-}=\sqrt2-1=\textrm{0,41421}\)
Dans le chlorure de sodium, ce rapport est plus important et les anions ne sont plus tangents.