Mise en évidence
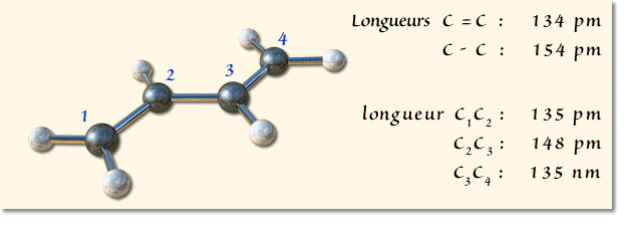
La molécule de 1,3-butadiène \(\textrm C_4\textrm H_6\)
On a représenté ci-dessous un modèle moléculaire de ce composé en y reportant les longueurs de liaisons carbone-carbone.
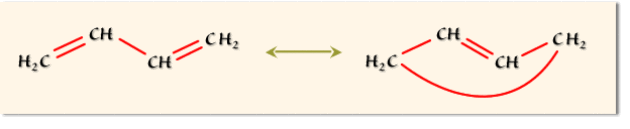
Le schéma de Lewis classique pour cette molécule fait apparaître deux liaisons doubles et une liaison simple centrale carbone-carbone. Or la longueur de la liaison centrale est plus courte que la longueur d'une liaison simple standard et les liaisons pendantes sont plus longues que les liaisons éthyléniques. Le renforcement de la liaison centrale est lié à l'existence d'une seconde formule mésomère (minoritaire) et on doit donc considérer que le butadiène est une molécule conjuguée répondant au schéma de résonance suivant :
Il y a donc un renforcement de cette liaison centrale au détriment des liaisons voisines. Ces liaisons possèdent à des degrés divers un caractère intermédiaire entre liaison simple et liaison double, ce que ne traduit pas la formule de Lewis classique.
Remarque :
La seconde formule à liaison longue est minoritaire dans la résonance. L'appariement entre électrons distants n'apporte pas en effet de stabilisation importante car le recouvrement entre les orbitales \(2\textrm p\) des carbones 1 et 4 est très faible.
La molécule de benzène \(\textrm C_6\textrm H_6\)
On a représenté ci-dessous un modèle moléculaire du benzène en y reportant les longueurs de liaisons carbone-carbone.
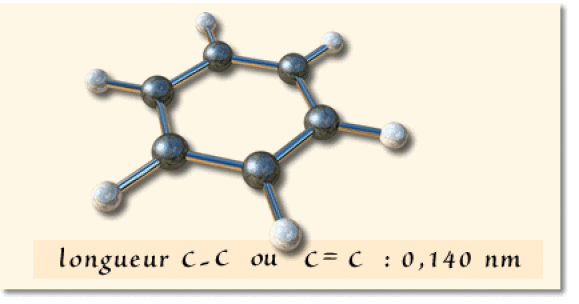
Cette molécule est de symétrie hexagonale parfaite. Toutes les liaisons sont de même longueur, dans le même plan. Un schéma de Lewis classique unique pour cette molécule tel que :
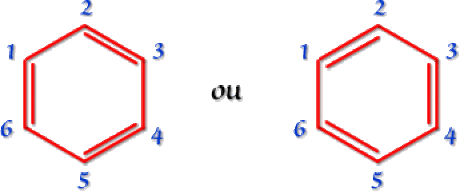
ne rend pas compte de la répartition électronique car il fait apparaître trois liaisons doubles \(\textrm C=\textrm C\) et trois liaisons simples. La longueur de liaison expérimentale est en fait intermédiaire entre celle d'une liaison simple et d'une liaison double. Cette valeur traduit la résonance entre les deux formules majoritaires de Kékulé. L'hybride de résonance rétablit alors l'équivalence des liaisons.
Attention :
Par commodité, on se contente souvent d'une seule représentation de Lewis, notamment lors de l'écriture de mécanismes réactionnels. Le chimiste doit cependant toujours avoir à l'esprit l'existence de l'hybride de résonance lorsqu'il est en présence de structures conjuguées.