Aromaticité et réactivité
Durée : 14 mn
Note maximale : 6
Question
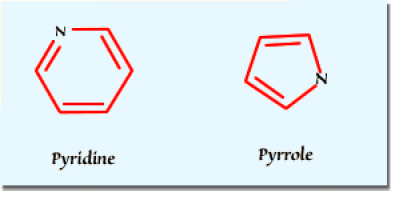
a. Montrer que la pyridine et le pyrrole sont des hétérocycles aromatiques.
b. Ceci est-il encore vrai en milieu acide ?
Solution
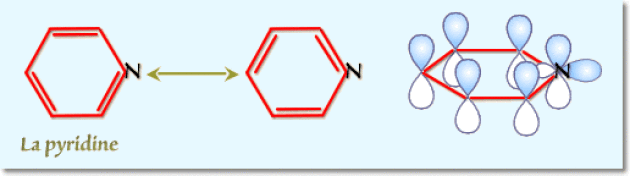
a. La pyridine possède 6 électrons \(\textrm{p}\) (orbitales \(\textrm{p}\) sensiblement parallèles et orthogonales au plan du cycle) et un doublet non liant dans le plan du cycle. Elle possède donc les \((4\textrm n + 2)\) électrons d'aromaticité de Hückel \((\textrm{ici 5 + 1})\).
Le pyrrole comporte \(\mathrm4\) électrons \(\textrm{p}\) pour les deux doubles liaisons conjuguées du cycle et \(\mathrm2\) électrons \(\textrm{p}\) de l'azote conjugués avec les précédents. Là encore on a \(\mathrm6\) électrons \((\textrm{ici 4 + 2})\) à orbitales parallèles répondant à la règle de Hückel. Les deux hétérocycles sont donc aromatiques.
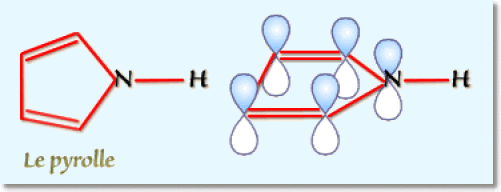
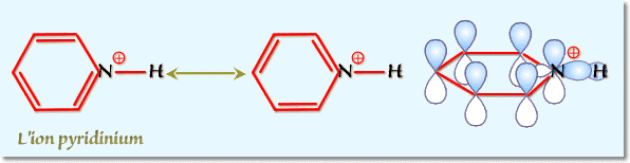
b. En milieu acide la pyridine conduit au chlorure de pyridinium : le proton \(\textrm H^+\) se fixe sur le doublet non liant et non conjugué qui donne son caractère basique à la pyridine. Il n'y a pas perte de l'aromaticité dans l'ion pyridinium.
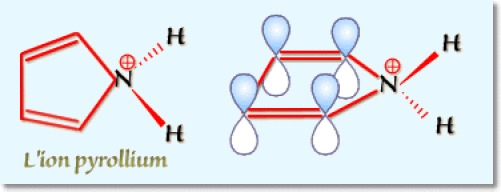
Par contre, le doublet non liant du pyrrole qui fixe le proton compte au nombre des électrons d'aromaticité et la protonation se manifeste alors par une perte d'aromaticité dans l'ion pyrrollium :