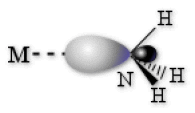
Liaison σ dans les complexes : exemple de NH3
Dans cette partie, nous allons utiliser comme exemple de ligand la molécule \(\textrm{NH}_3\). Cette dernière possède un seul doublet libre sur l'atome d'azote : \(\vert\textrm{NH}_3\). Ce doublet est situé dans une orbitale de type \(\textrm{sp}^3\). Lorsque \(\textrm{NH}_3\) est lié par l'azote à un atome métallique \(\textrm M\) dans un complexe octaédrique, l'orbitale \(\textrm{sp}^3\) est dirigée vers le métal, comme schématisé sur la figure ci-dessous. Ces orbitales vont donc donner lieu à des liaisons de type \(\sigma\), nous les appellerons orbitales \(\sigma\) par la suite. Chaque ligand \(\textrm{NH}_3\) apportant une orbitale \(\sigma\), 6 sont à considérer dans un complexe octaédrique.
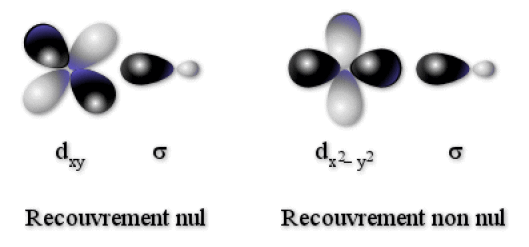
Dans une approche simplifiée, seules sont prises en compte les 5 orbitales \(\textrm d\) du métal et les 6 orbitales \(\sigma\) des ligands. De plus, nous admettrons que les énergies des orbitales \(\sigma\) des ligands ont une énergie inférieure à celles du métal. La première question à se poser est celle de la possibilité de combiner les orbitales \(\sigma\) avec les orbitales \(d\) du métal. Les orbitales \(\textrm d_{\textrm{xy}}\), \(\textrm d_\textrm{{xz}}\)et \(\textrm d_\textrm{{yz}}\) pointant ENTRE les ligands, elles ne peuvent pas former de liaisons \(\sigma\) . Seules les orbitales \(\textrm d_{\textrm z^2}\) et \(\textrm d_{\textrm x^2 - \textrm y^2}\) peuvent avoir un recouvrement non nul avec les orbitales \(\sigma\) des ligands car elles pointent VERS les ligands. Ceci est schématisé sur la figure ci-dessous pour les orbitales \(\textrm d_\textrm{{xy}}\) et \(\textrm d_{\textrm x^2 - \textrm y^2}\) .
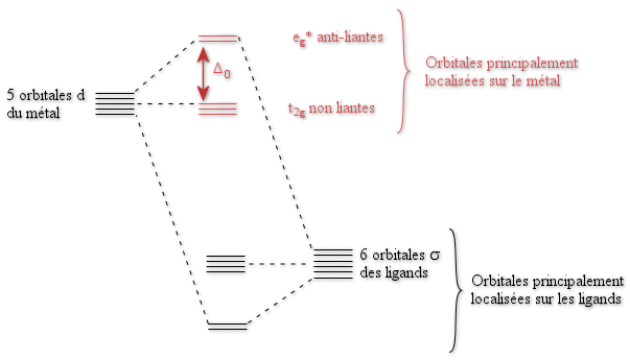
Il est maintenant possible de construire un diagramme simplifié des orbitales moléculaires pour le complexe \(\textrm{ML}_6\), décrit sur la figure ci-après.
Conclusion
Les orbitales \(\textrm d\) du métal, par interaction avec les orbitales \(\sigma\) des ligands vont se scinder en deux groupes : les orbitales \(\textrm t_{2\textrm g}\) non-liantes qui vont rester au même niveau énergétique ; et les orbitales \(\textrm e_\textrm g^*\) anti-liantes qui seront plus hautes en énergie. La différence d'énergie entre ces niveaux est appelée \(\Delta_0\), et a la même signification que le paramètre 10 Dq dans la théorie du champ cristallin.
Notons que ce diagramme est simplifié dans le sens où il ne prend en compte que les orbitales \(\textrm d\) du métal. Une version plus rigoureuse devrait en plus prendre en compte les orbitales \(\textrm s\) et \(\textrm p\) de la couche de valence du métal. Toutefois, les conclusions sur la nature liante/non-liante/anti-liante des orbitales \(\textrm d\) ne changent pas lors de la prise en compte de ces orbitales. Un tel diagramme simplifié est suffisant dans le cadre de ce cours où l'on s'intéresse en priorité aux orbitales \(\textrm d\).
Par la suite, nous allons mettre en évidence l'évolution de ce diagramme si les ligands, en plus des orbitales \(\sigma\), présentent des orbitales de type \(\pi\).