Liaison π dans les complexes , exemple d'un ligand π–donneur Cl-
Prenons à présent l'exemple du ligand \(\textrm{Cl}^-\). Les ions \(\mid\substack{\frac{\textrm{ }\textrm{ }}{ }}{\stackrel{\frac{\textrm{ }\textrm{ }}{ }}{\textrm{Cl}}}\mid^-\) portent 4 paires libres : l'une est située dans l'orbitale \(3s\) et les trois autres dans les orbitales \(3\textrm p\). Lorsque le ligand \(\textrm{Cl}^-\) est lié à un atome métallique dans un complexe octaèdrique, examinons le recouvrement des orbitales.
Nous admettrons en première approximation que l'orbitale \(3\textrm s\) est trop basse en énergie pour se combiner avec les orbitales \(\textrm d\) du métal. Seules les orbitales \(3\textrm p\) du métal vont intervenir dans le diagramme d'orbitales qui va nous intéresser. Nous admettrons de plus que toutes ces orbitales sont situées plus bas en énergie que les orbitales \(\textrm d\) du métal.
Comme dans le cas précédent (ligand purement \(\sigma\)-donneur), l'orbitale \(\textrm p\) dirigée selon l'axe métal–ligand va pouvoir se combiner avec les orbitales de type \(\textrm e_\textrm g\) du métal. La nouveauté va se situer au niveau des orbitales \(\textrm t_{2\textrm g}\). De « spectatrices », elles vont passer au rôle d'« actrices », en se combinant avec les orbitales \(\textrm p\) des ligands restantes. Il y a 6 orbitales \(\textrm p\) des ligands dirigées vers le métal, il reste donc en tout 12 orbitales \(\textrm p\) susceptibles d'interagir avec les orbitales du métal.
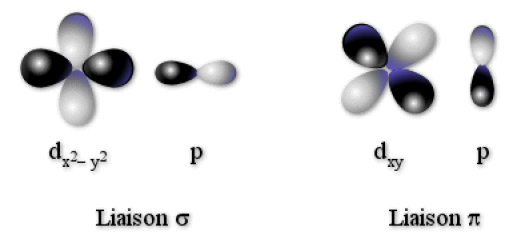
Nous avons schématisé sur la figure ci-dessous, une interaction de type liante \(\sigma\) entre une orbitale de type \(\textrm d_{\textrm x^2 - \textrm y^2}\) et une orbitale \(p\) du ligand correctement orientée ; ainsi qu'une interaction de type liante \(\pi\) entre une orbitale de type \(\textrm d_{\textrm{xy}}\) et une orbitale \(\textrm p\) du ligand correctement orientée.
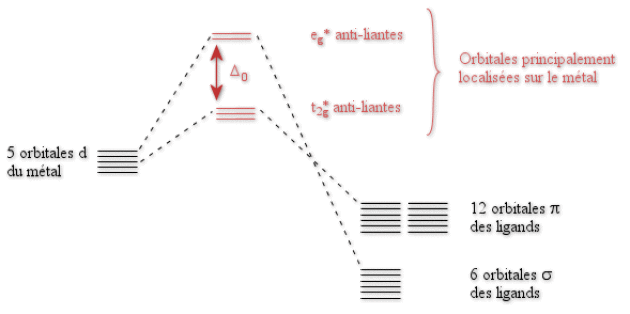
Il est maintenant possible de construire un diagramme simplifié des orbitales moléculaires pour le complexe octaédrique \(\textrm{MCl}_6\) décrit ci-après sur la figure ci-dessous (les orbitales principalement localisées sur les ligands obtenues après les différentes combinaisons ont été omises par souci de clarté).
Conclusion
Si les orbitales \(\textrm e_\textrm g^*\) restent anti-liantes comme dans le cas de \(\textrm{NH}_3\) ; les orbitales \(\textrm t_{2\textrm g}^*\) du métal sont maintenant anti-liantes. Par rapport au cas précédent, ces dernières orbitales ont vu leur énergie augmenter, donc se rapprocher de celle des \(\textrm e_\textrm g^*\). Le valeur de \(\Delta_0\) a donc diminué. \(\textrm{Cl}^-\), comme tous les ligands \(\sigma\)-donneur et \(\pi-\)donneur, est un ligand à champ faible.