Les chlorures
La grande variété des propriétés et des structures des chlorures, à travers la classification périodique, peut s'expliquer par l'évolution du caractère ionique/covalent de la liaison chimique présente dans ces composés.
L'ionicité de la liaison dans les chlorures sera d'autant plus grande que la différence d'électronégativité des deux atomes impliqués dans la liaison sera grande. Donc, puisque le chlore est très électronégatif, il y aura des composés plutôt covalents avec les éléments placés à droite et/ou en haut dans la classification, et des composés plutôt ioniques pour les éléments placés à gauche et/ou en bas.
La covalence de la liaison métal-chlore augmente aussi beaucoup avec le degré d'oxydation du métal \(\textrm M\).
Remarque :
Plus \(n\) est grand et plus le degré d'oxydation du cation \(\textrm M^{n+}\) est élevé. Le cation va devenir fortement polarisant et va donc attirer la densité électronique de l'ion chlorure \(\textrm{Cl}^-\) qui est beaucoup plus gros, la covalence augmente.
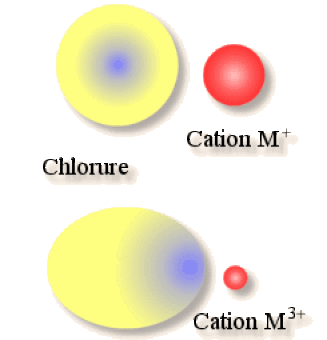
Donc un chlorure \(\textrm{MCl}_n\) sera d'autant plus ionique que \(n\) est faible et d'autant plus covalent que \(n\) est élevé.
La dimensionnalité des chlorures va augmenter avec l'ionicité de la liaison. En effet, dans la liaison ionique, plus un ion est entouré d'ions de charge opposée, plus l'édifice est stable. Donc, dans un édifice ionique, les cations cherchant à s'entourer de beaucoup d'anions et les anions cherchant à s'entourer de beaucoup de cations mènent à un édifice tridimensionnel.
Par contre, dans un édifice covalent, la liaison repose sur des doublets liants localisés entre les atomes, et ceux-ci ont tendance à se repousser entre eux autour d'un même atome. Donc, dans un édifice covalent, il est beaucoup plus facile de rencontrer des structures en feuillet ou linéaires, etc
Ces évolutions de propriétés sont illustrées par deux exemples aux pages suivantes.