Exemple 2 : les chlorures du titane
Le titane possède 3 degrés d'oxydation courants, donc trois types de chlorures.
Ici on voit l'évolution de l'ionicité qui diminue avec le degré d'oxydation de l'atome de titane.
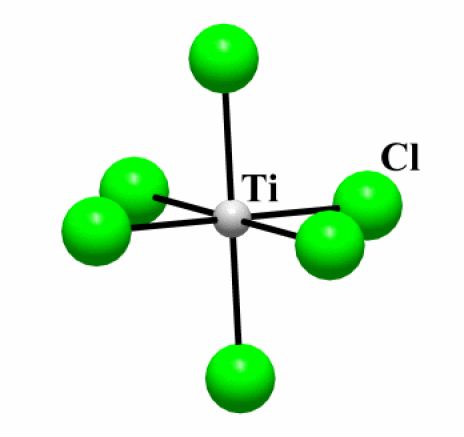
Exemple : TiCl2
D.O. Ti | Etat (25°C) | Structure | Type de structure | Coordinence | Réaction avec l'eau | |
\(\mathrm{TiCl_2}\) | II | solide | 2D | \(\mathrm{CdI_2}\) | [6] | soluble |
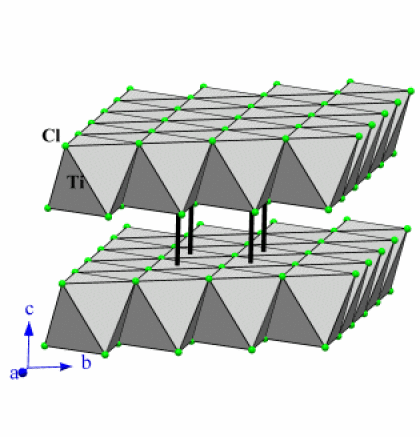
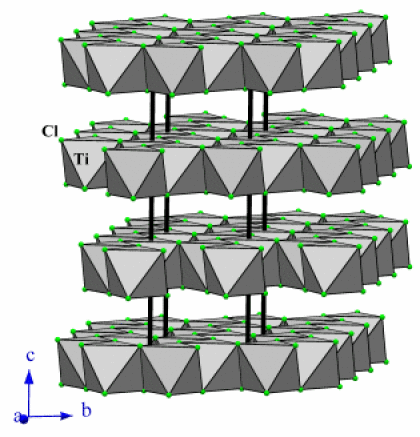
Exemple : TiCl3
D.O. Ti | Etat (25°C) | Structure | Type de structure | Coordinence | Réaction avec l'eau | |
\(\mathrm{TiCl_3}\) | III | Solide | 2D | \(\mathrm{AlCl_3}\) | [6] | hygroscopique* |
* grande affinité pour l'eau.
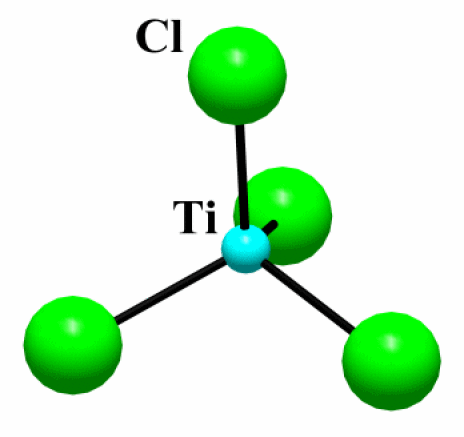
Exemple : TiCl4
D.O. Ti | Etat (25°C) | Structure | Type de structure | Coordinence | Réaction avec l'eau | |
\(\mathrm{TiCl_4}\) | IV | liquide | molécule | molécule tétraédrique | [4] | très hygroscopique** |
** \(\textrm{TiCl}_4\textrm{ (s)} + 6.\textrm H_2\textrm O\to\textrm{TiO}_2\textrm{ (s)}+4.\textrm H_3\textrm O^++4.\textrm{Cl}^-\textrm{ (aq)}\), \(\textrm{TiCl}_4\) fume à l'air.