Exemple 1 : les chlorures des éléments de la 3ème période
Dans ce tableau, on a résumé quelques propriétés des chlorures des éléments de la 3ème période.
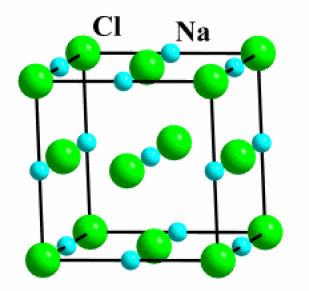
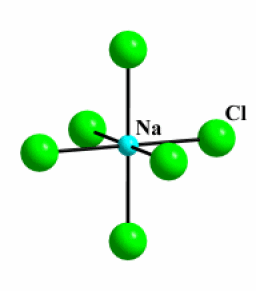
Exemple : NaCl
Etat (25°C) | \(\mathrm{T_{fusion}}\)(°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
NaCl | Solide | 800 | Ionique | 2,1 | 3D |
* différence d'électronégativité (échelle de Pauling).
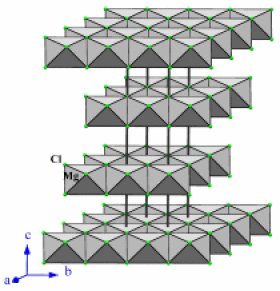
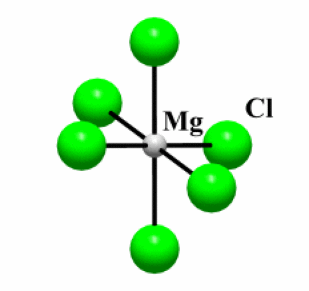
Exemple : MgCl2
Etat (25°C) | \(\mathrm{T_{fusion}}\)(°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{MgCl_2}\) | Solide | 700 | Ionique | 1,8 | 2D |
* différence d'électronégativité (échelle de Pauling).
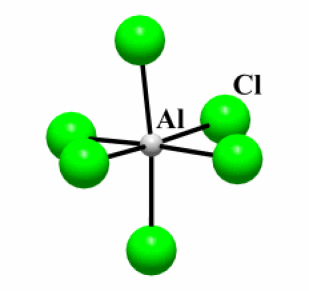
Exemple : AlCl3
Etat (25°C) | \(\mathrm{T_{fusion}}\) (°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{AlCl_3}\) | Solide | 250 | Covalente | 1,5 | 2D |
* différence d'électronégativité (échelle de Pauling).
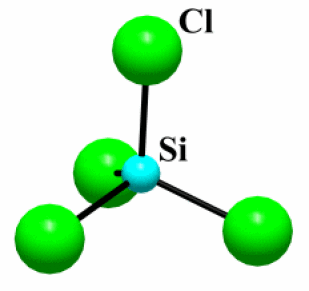
Exemple : SiCl4
Etat (25°C) | \(\mathrm{T_{fusion}}\) (°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{SiCl_4}\) | Liquide | -69 | Covalente | 1,2 | Molécule |
* différence d'électronégativité (échelle de Pauling).
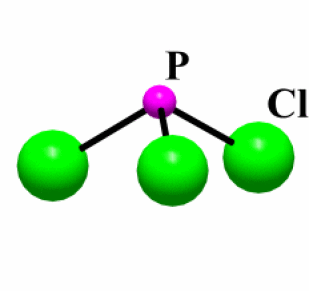
Exemple : PCl3
Etat (25°C) | \(\mathrm{T_{fusion}}\) (°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{PCl_3}\) | Liquide | -112 | Covalente | 0,9 | Molécule |
* différence d'électronégativité (échelle de Pauling).
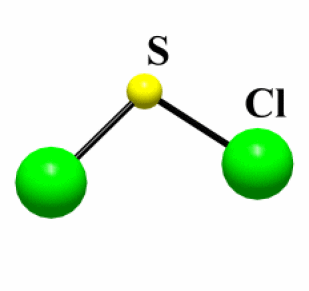
Exemple : SCl2
Etat (25°C) | \(\mathrm{T_{fusion}}\) (°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{SCl_2}\) | Liquide | -122 | Covalente | 0,5 | Molécule |
* différence d'électronégativité (échelle de Pauling).
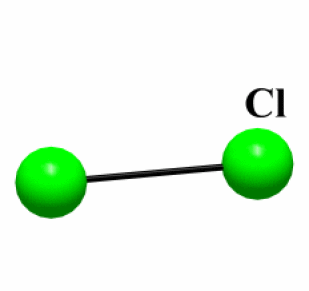
Exemple : Cl2
Etat (25°C) | \(\mathrm{T_{fusion}}\) (°C) | Type de liaison | \(\Delta_{\chi}\)* | Structure | |
\(\mathrm{Cl_2}\) | Gaz | -101,5 | Covalente | 0 | Molécule |
* différence d'électronégativité (échelle de Pauling).
Réactions avec l'eau des chlorures des éléments de la 3ème période
Lorsqu'on considère l'action de l'eau sur les chlorures, deux types de comportement extrêmes sont possibles :
Les chlorures ioniques ne réagissent pas chimiquement avec l'eau, mais par contre ils sont fortement dissous. En effet, les ions de l'édifice sont très stabilisés dans l'eau à l'état solvaté, car l'eau est un solvant très polaire.
\(\textrm{NaCl}\stackrel{\textrm H_2\textrm O}{\longrightarrow}\textrm{Na}^+\textrm{ (aq)}+\textrm{Cl}^-\textrm{ (aq)}\textrm{ }\textrm{ }\textrm{solubilité}=357 \textrm{g/L (0°C)}\)
\(\textrm{MgCl}_2\stackrel{\textrm H_2\textrm O}{\longrightarrow}\textrm{Mg}^{2+}\textrm{ (aq)}+2.\textrm{Cl}^-\textrm{ (aq)}\textrm{ }\textrm{ }\textrm{solubilité}=543 \textrm{g/L (20°C)}\)
Les chlorures covalents sont des acides de Lewis (l'atome central est accepteur de doublet). Par conséquent, il y aura une réaction vive sur l'eau (hydrolyse).
\(2.\textrm{AlCl}_3+9.\textrm H_2\textrm O\to\textrm{Al}_2\textrm O_3+6.\textrm H_3\textrm O^++6.\textrm{Cl}^-\textrm{ (aq)}\)
\(\textrm{SiCl}_4+6.\textrm H_2\textrm O\to\textrm{SiO}_2+4.\textrm H_3\textrm O^++4.\textrm{Cl}^-\textrm{ (aq)}\)
\(\textrm{PCl}_3+7.\textrm H_2\textrm O\to\textrm{H}_3\textrm{PO}_3+3.\textrm H_3\textrm O^++3.\textrm{Cl}^-\textrm{ (aq)}\)
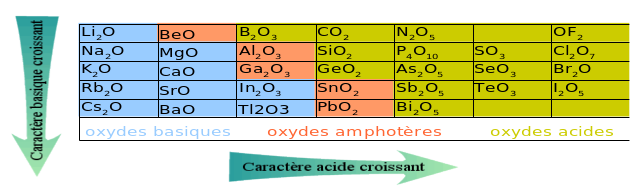
Les produits de réaction ont une acidité de plus en plus importante lorsque l'on se déplace vers la droite de la classification périodique, tout comme pour les oxydes.
Rappel : Acido-basicité
Le caractère basique de l'oxyde va de pair avec son caractère ionique, le caractère acide avec son caractère covalent.
Un oxyde ionique est basique, car il contient l'ion \(\textrm O^{2-}\) qui est hydrolysé en \(\textrm{OH}^-\):
\(\textrm M_2^+\textrm O^{2-}+\textrm H_2^{\delta+}\textrm O^{2\delta-}\to2.\textrm M^+\textrm{ (aq)}+2.\textrm{OH}^-\textrm{ (aq)}\)
Les oxydes covalents, et plus particulièrement les oxydes moléculaires, sont généralement de type acide : c'est-à-dire que le \(\textrm{pH}\) de la solution devient acide lorsqu'ils sont dissous dans l'eau, ou alors qu'ils sont solubles en milieu basique :
\(\textrm M_2\textrm O+\textrm H_2^{\delta+}\textrm O^{2\delta-}\to\textrm M_2\textrm O_2^{\delta-}\textrm H_2^{\delta+}\to2.\textrm{MO}^-\textrm{ (aq)}+2.\textrm H^+\textrm{ (aq)}\)
En reportant dans le Tableau Périodique pour chaque élément le comportement de l'oxyde, on observe que les oxydes basiques correspondent aux combinaisons de l'oxygène avec les métaux peu électronégatifs, c'est-à-dire des oxydes ioniques. Au contraire, les oxydes acides résultent de la formation de liaisons covalentes avec les non-métaux. Les oxydes amphotères se situent à la frontière des deux groupes.