Diagramme de Frost
Le diagramme de Frost fait partie des outils graphiques permettant de prévoir les réactions d'oxydoréduction.
On considère un élément (ici le chlore) et ses différents degrés d'oxydation dans des composés sélectionnés (ici les oxoacides de chlore). On veut pouvoir discuter de la stabilité relative et absolue des différentes espèces.
Par définition et par convention, on porte en ordonnée le potentiel électrochimique du demi-couple rédox formé par l'espèce considérée et le degré zéro (ici \(\textrm{Cl}_2\)), multiplié par le nombre d'électrons échangés dans la demi-réaction. Ce nombre d'électrons est également le degré d'oxydation de l'espèce considérée.
Voici le diagramme complet du chlore à \(\textrm{pH=0}\) et \(\textrm{pH=14}\) .
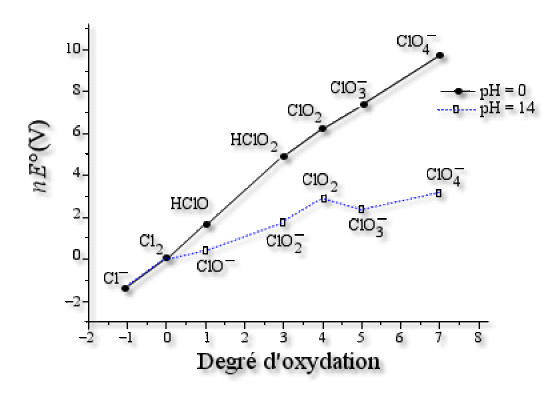
Explication : Construction du diagramme de Frost
On trace le diagramme pour une valeur de \(\textrm{pH}\) donnée. Considérons deux cas extrêmes :
solution acide : \(\textrm{pH=0}\)
solution basique : \(\textrm{pH=14}\)
Les composés considérés sont classés suivant leur degré d'oxydation :
\(\mathrm{Cl^-}\) | \(\mathrm{Cl_2}\) | \(\mathrm{HClO}\) | \(\mathrm{HClO_2}\) | \(\mathrm{ClO_2}\) | \(\mathrm{ClO^-_3}\) | \(\mathrm{ClO^-_4}\) |
-I | 0 | +I | +III | +IV | +V | +VII |
Et on donne :
\(E°\textrm{(Cl}_2\textrm{ (g)/Cl}^-\textrm)=1\textrm,36 \textrm V\)
\(E°\textrm{(HClO/Cl}_2\textrm)=1\textrm,63 \textrm V\)
\(E°\textrm{(HClO}_2\textrm{/HClO})=1\textrm,67 \textrm V\)
\(E°\textrm{(ClO}_2\textrm{/HClO}_2\textrm)=1\textrm,19 \textrm V\)
\(E°\textrm{(ClO}_3^-\textrm{/ClO}_2\textrm)=1\textrm,18 \textrm V\)
\(E°\textrm{(ClO}_4^-\textrm{/ClO}_3^-\textrm)=1\textrm,20 \textrm V\)
Tracer le diagramme de Frost revient à relier deux à deux des points dont les abscisses correspondent au degré d'oxydation du chlore et l'écart en ordonnée est \(nE°\). \(E°\) est le potentiel standard du couple redox formé par les composés correspondant aux deux points reliés et \(n\) le nombre d'électrons échangés au cours de la demi-réaction du couple.
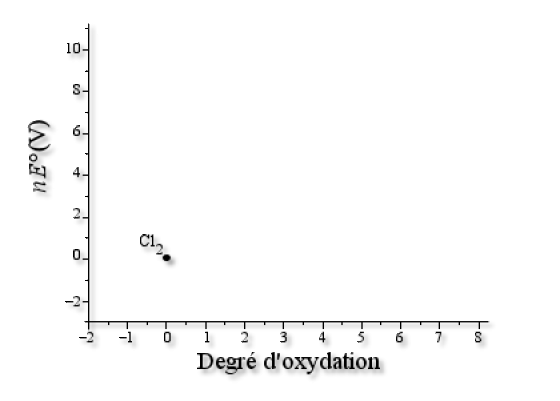
On fixe l'origine sur le point qui correspond au degré d'oxydation nul, c'est-à-dire \(\textrm{Cl}_2\). \(\textrm{Cl}_2\) correspond donc au point de coordonnés (0,0) sur le graphe.
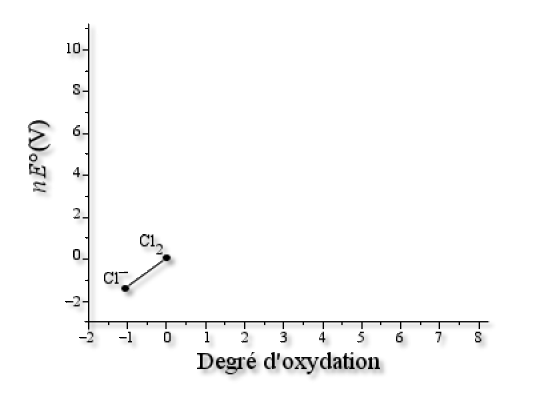
Segment \(\textrm{Cl}^-\textrm{/Cl}_2\) :
Pour le couple rédox \(\textrm{Cl}^-\textrm{/Cl}_2\)
\(\frac{1}{2}.\textrm{Cl}_2+1.\textrm e^-\to\textrm{Cl}^-\textrm{ }\textrm{ }E°=1\textrm,36 \textrm V\)
On considère donc les points \(\textrm{Cl}^-(-1 ;\textrm y_{\textrm{Cl}^-})\) et \(\textrm{Cl}_2(0;0)\) et \(\textrm y_{\textrm{Cl}_2}-\textrm y_{\textrm{Cl}^-}=0-\textrm y_{\textrm{Cl}^-}=nE°=1\times1\textrm,36=1\textrm,36 \textrm V\) donc \(\textrm y_{\textrm{Cl}^-}=-1\textrm,36 \textrm V\).
Donc \(\textrm{Cl}^-(-1;-1,36)\)
Segment \(\textrm{Cl}_2\textrm{/HClO}\) :
Pour le couple rédox \(\textrm{Cl}_2\textrm{/HClO} \):
\(\textrm{HClO}+\textrm e^-+\textrm H^+\to\frac{1}{2}.\textrm{Cl}_2+\textrm H_2\textrm O\textrm{ }\textrm{ }E°=1\textrm,63 \textrm V\)
On considère donc les points \(\textrm{HClO}(1 ;\textrm y_{\textrm{HClO}})\) et \(\textrm{Cl}_2(0;0)\) et \(\textrm y_{\textrm{HClO}_2}-\textrm y_{\textrm{Cl}_2}=\textrm y_{\textrm{HClO}}-0=nE°=1\times1\textrm,63=1\textrm,63 \textrm V\) donc \(\textrm y_{\textrm{HClO}}=1\textrm,63 \textrm V\).
Donc\( \textrm{HClO}(1;1,63)\)
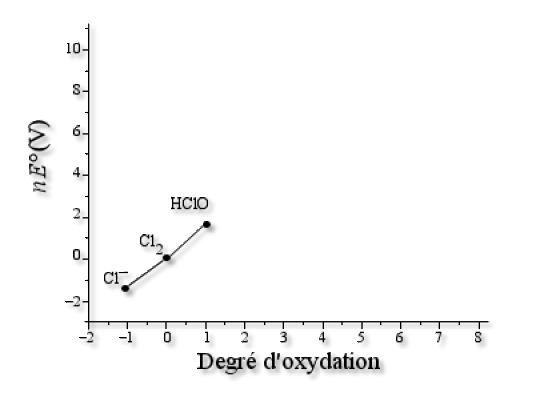
Diagramme complet :
Pour construire les derniers points on continue de la même façon, l'ordonnée d'un point est égale à l'ordonnée du point précédent plus la valeur \(nE°\) qui correspond au demi couple formé par les composés de ces deux points successifs.
Ainsi pour \(\textrm{HClO}_2\), \(\textrm y_{\textrm{HClO}_2}=\textrm y_{\textrm{HClO}}+nE°(\textrm{HClO}_2\textrm{/HClO})\) avec :
\(\textrm{HClO}_2+2.\textrm e^-+2.\textrm H^+\to\textrm{HClO}+\textrm H_2\textrm O\textrm{ }\textrm{ }E°=1\textrm,67 \textrm V\)
\(\textrm y_{\textrm{HClO}_2}=1\textrm,63+2\times1\textrm,67=4\textrm,97 \textrm V\)
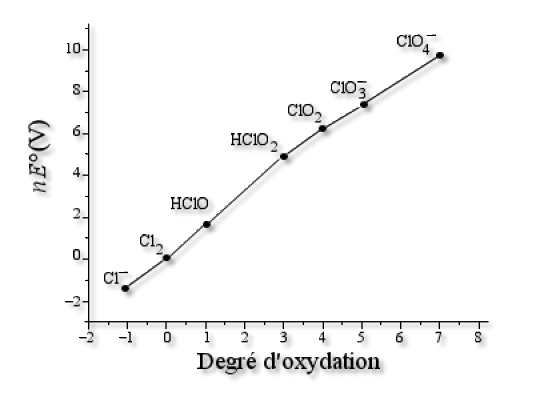
Les abscisses et les ordonnées obtenues sont reportées dans le tableau ci-dessous :
\(\mathrm{Cl^-}\) | \(\mathrm{Cl_2}\) | \(\mathrm{HClO}\) | \(\mathrm{HClO_2}\) | \(\mathrm{ClO_2}\) | \(\mathrm{ClO^-_3}\) | \(\mathrm{ClO_4^-}\) |
-I | 0 | +I | +III | +IV | +V | +VII |
-1,36 | 0 | 1,63 | 4,97 | 6,16 | 7,34 | 9,74 |
On obtient :
En milieu basique on considère les valeurs de potentiel redox suivants :
\(E°^*(\textrm{Cl}_2\textrm{/Cl}^-)=1\textrm,36 \textrm V\)
\(E°^*(\textrm{ClO}^-\textrm{/Cl}_2)=0\textrm,42 \textrm V\)
\(E°^*(\textrm{ClO}_2^-\textrm{/ClO}^-)=0\textrm,68 \textrm V\)
\(E°^*(\textrm{ClO}_2\textrm{/ClO}_2^-)=1\textrm,07 \textrm V\)
\(E°^*(\textrm{ClO}_3^-\textrm{/ClO}_2)=-0\textrm,48 \textrm V\)
\(E°^*(\textrm{ClO}_4^-\textrm{/ClO}_3^-)=0\textrm,37 \textrm V\)
\(E°^*\) : potentiel redox standard apparent.
