Les étapes de la description d'un mécanisme réactionnel
Nous allons aborder le protocole classique de la caractérisation d'une réaction chimique, tant d'un point de vue structural qu'énergétique.
Généralement, les structures des réactifs et des produits -qui sont des minimums d'énergie sur la surface- sont caractérisés par un protocole d'optimisation de la géométrie.
On pourra se reporter au chapitre qui traite des protocoles de minimisation de l'énergie.
http://uel.unisciel.fr/chimie/modelisation/modelisation_ch03/co/modelisation_ch03.html
On vérifie alors que les fréquences sont toutes positives. Dans certains cas, les structures ont même pu être caractérisées expérimentalement, ce qui va simplifier le protocole.
On prendra soin d'utiliser le même niveau de théorie pour calculer le Hessien que pour réaliser l'optimisation de géométrie. En effet, la nature de la surface d'énergie est légèrement dépendante de l'hamiltonien utilisé. En conséquence, un minimum d'énergie à un niveau de théorie donné ne le sera pas forcément à un autre niveau.
L'identification de la structure de l'état de transition est le point le plus délicat. Il s'agit de la deviner, généralement sur la base de « l'intuition du chimiste ». Généralement, il s'agit d'une structure qui se trouve à mi-chemin entre celle du réactif et celle du produit. Divers algorithmes permettent de créer des structures d'état de transition sur la base de celles des réactifs et des produits.
A chaque essai, on réalise une optimisation de la structure, avec la contrainte qu'un des vecteurs propres de la matrice du hessien soit associé à une valeur propre la plus négative possible (pour un de ces modes normaux, on maximise son énergie). On vérifie alors que la structure obtenue possède un mode de vibration imaginaire qui implique bien la coordonnée de réaction envisagée.
Une fois les points stationnaires caractérisés, on identifie leur énergie, ce qui permet de décrire les aspects thermodynamiques et cinétiques de la réaction.
L'aspect thermodynamique est dicté par la différence d'énergie entre le réactif et le produit. Si le produit est très stable par rapport au réactif, la réaction est favorisée d'un point de vue thermodynamique (elle est exothermique). On obtient cette information par calcul de la différence d'énergie entre le réactif et le produit, comme indiqué que la flèche bleue de l'image suivante :
La cinétique de la réaction est contrôlée par la barrière d'énergie à franchir pour passer du réactif à l'état de transition qui mènera au produit voulu. Il s'agit de la flèche rouge sur l'image.
Certaines réactions chimiques peuvent se comporter différemment. Par exemple, il existe des réactions pour lesquelles il n'existe pas d'état de transition. La réaction à alors lieu spontanément, comme dans le cas de réaction faisant intervenir des radicaux ou des ions.
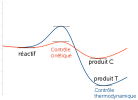
Aussi, dans certains cas, des réaction compétitives sont à considérer. L'image suivante illustre une compétition entre un chemin réactionnel contrôlé par la cinétique et un autre chemin contrôlé par la thermodynamique.
Dans le contrôle cinétique, la cinétique est très rapide (car l'énergie pour atteindre l'état de transition est faible) mais le produit n'est pas très stabilisé par rapport au réactif (courbe orange). Ce réactif peut alors se transformer de nouveau en réactif par le chemin inverse. Dans le contrôle thermodynamique, le produit est très stabilisé mais la barrière à franchir pour atteindre l'état de transition ralentit fortement le processus (courbe bleue). L'arrêt de la réaction au bout d'un temps court permettra d'isoler le produit contrôlé par la cinétique (produit C). En revanche, au bout d'un temps bien plus long, on obtiendra de façon très majoritaire le produit contrôlé par l'aspect thermodynamique (produit T).
Exemple :
Le thème n°6 : Description d'une réaction chimique, propose l'étude d'une étape de réaction chimique. Vous y déterminerez la nature du réactif, du produit ainsi que de l'état de transition qui les relie.