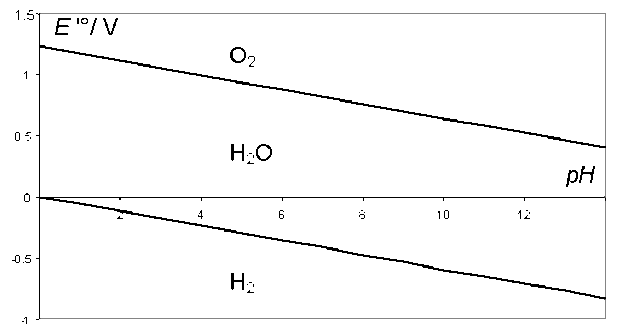
Diagramme E / pH de l'eau
Les potentiels apparents des deux couples rédox de l'eau sont donc :
\(E'^0_{\textrm H^+ / \textrm H_2} = - \textrm{0,06 pH}\) et \(E'^0_{\textrm O_2 / \textrm H_2\textrm O} =\textrm{1,23} - \textrm{0,06 pH}\)
Si on examine le graphe donnant la variation des 2 potentiels standard apparents de l'eau, on définit le domaine d'existence de l'eau entre ces 2 potentiels :
D'après la thermodynamique, une solution aqueuse à l'équilibre ne pourrait pas contenir d'oxydant plus fort que \(\textrm O_2\) ou de réducteur plus fort que \(\textrm H_2\). On retrouve le même effet de nivellement que pour les acides forts et les bases fortes dans l'eau.
Ainsi le fluor \(\textrm F_2\) et le sodium \(\textrm{Na}\), respectivement oxydant et réducteur très forts, ne peuvent pas exister dans l'eau.
Dans la réalité, les réactions sont souvent très lentes (contrairement aux réactions acido-basiques) et elles se manifestent peu. On parle alors d'équilibres métastables.