Influence du pH sur la solubilité de certains composés ioniques
Lorsqu'un des ions d'un composé ionique possède des propriétés acides ou basiques, le fait d'imposer (par exemple en utilisant une solution tampon) le \(\textrm{pH}\) du milieu dans lequel on dissout ce composé va modifier sa solubilité.
Cela explique la redissolution de certains précipités quand on ajoute une petite quantité d'acide ou de base au milieu dans lequel ils se trouvent :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Exemples de composés dont la solubilité varie avec le pH
Ce sont les composés dont l'un des ions possède un caractère acide ou basique, c'est à dire libérant en solution l'un des ions suivants :
Exemples d'anions : hydroxyde \(\textrm{OH}^-\) , éthanoate \(\textrm{CH}_3\textrm{COO}^-\), sulfure \(\textrm{pH}\) \(S^{2-}\), nitrite \(\textrm{NO}_2^-\) , carbonate \(\textrm{CO}_3^{2-}\), hydrogénocarbonate \(\textrm{HCO}_3^-\) etc... Tous ces anions possèdent des propriétés basiques ou amphotères.
Exemples de cations : ammonium \(\textrm{NH}_4^+\), éthyl-ammonium \(\textrm C_2\textrm H_5\textrm{NH}_3^+\), etc.., cations ayant un caractère acide.
On peut donc prévoir que la solubilité[1] de l'hydroxyde de Zinc \(\textrm{Zn(OH)}_2\) ou celle du chlorure d'ammonium \(\textrm{NH}_4\textrm{Cl}\) va dépendre du \(\textrm{pH}\).
Exemple : 1. Solubilité de l'éthanoate d'argent en fonction du pH
L'éthanoate d'argent se dissocie en ions éthanoate (base faible) et argent (sans propriété acido-basique dans l'eau) :
\(\textrm{CH}_3\textrm{COOAg}_{(s)}\rightleftarrows\textrm{ CH}_3\textrm{COO}^-+\textrm{Ag}^+\textrm{ }K_1=K_s=2.10^{-3}\)
Dans l'eau, la base \(\textrm{CH}_3\textrm{COO}^-\) va à son tour réagir :
\(\textrm{CH}_3\textrm{COO}^-+\textrm{H}_2\textrm O\rightleftarrows\textrm{ CH}_3\textrm{COOH}+\textrm{OH}^-\textrm{ }K_2=\frac{K_a}{K_e}=10^{-\textrm{9,2}}\)
Et bien entendu, l'autoprotolyse de l'eau se produit toujours :
\(2\textrm H_2\textrm O\rightleftarrows\textrm{ H}_3\textrm O^++\textrm{OH}^-\textrm{ }K_3=K_e=10^{-14}\)
La solubilité s de l'éthanoate d'argent correspond à la quantité de matière de ce composé passant en solution dans un litre de cette solution ; c'est donc ici la concentration molaire de l'espèce dissoute formée : \(s = [\textrm{Ag}^+]\) . L'ion éthanoate peut se transformer en acide éthanoïque par le réaction 2 et le bilan de cette transformation s'écrit donc : \(s = [ \textrm{CH}_3\textrm{COO}^-] + [\textrm{CH}_3\textrm{COOH}]\) . La mise en équations pour le calcul de la solubilité s est donc :
Electroneutralité : \([\textrm{Ag}^+]+[\textrm H_3\textrm O^+]=[\textrm{CH}_3\textrm{COO}^-]+[\textrm{OH}^-]\)
\(K_s=[\textrm{Ag}^+].[\textrm{CH}_3\textrm{COO}^-]=s.[\textrm{CH}_3\textrm{COO}^-]=2.10^{-3}\)
\(K_2=\frac{[\textrm{CH}_3\textrm{COOH}].[\textrm{OH}^-]}{[\textrm{CH}_3\textrm{COOH}]}=10^{-\textrm{9,2}}\)
ou, \(K_a=\frac{[\textrm{CH}_3\textrm{COO}^-].[\textrm H_3\textrm O^+]}{[\textrm{CH}_3\textrm{COOH}]}=10^{-\textrm{4,8}}\) et \(K_e=[\textrm H_3\textrm O^+].[\textrm{OH}^-]=10^{-14}\)
\(s=[\textrm{CH}_3\textrm{COO}^-]+[\textrm{CH}_3\textrm{COOH}]\)
Il s'agit d'un système de 5 équations à 5 inconnues qui se résoudra facilement à condition de faire certaines approximations :
La solubilité dans l'eau pure s'obtient en considérant que la base éthanoate est très faible et que par conséquent \([\textrm H_3\textrm O^+] \ll s\) et \([\textrm{OH}^-]\ll s\) ; on obtient alors la relation \([\textrm{CH}_3\textrm{COO}^-] \# [\textrm{Ag}^+] = s\) et \(K_s = s^2\) soit \(s = \textrm{4,5}.10^{–2}\textrm{ mol.L}^{-1}\). Le calcul ultérieur de la concentration en ions hydroxyde dans une solution d'ion éthanoate à la concentration \(s\) donne \([\textrm{OH}^-] = \textrm{5,3}.10^{-6}\textrm{ mol.L}^{-1}\) ce qui confirme l'hypothèse \([\textrm{OH}^-]\ll s\). Le \(\textrm{pH}\) de la solution saturée d'éthanoate d'argent est 8,72.
La solubilité dans une solution tampon de \(\textrm{pH}\) imposé se calcule à partir du même système d'équations mais en considérant \([\textrm H_3\textrm O^+]\) et \([\textrm{OH}^-]\) connues et constantes. En notant \(\textrm h = [\textrm H_3\textrm O^+]\), il vient :
\(K_a=\frac{[\textrm{CH}_3\textrm{COO}^-].\textrm h}{[\textrm{CH}_3\textrm{COOH}]}=10^{-\textrm{4,8}}\) soit \([\textrm{CH}_3\textrm{COO}^-]=\frac{[\textrm{CH}_3\textrm{COO}^-].\textrm h}{K_a}\)
\(s=[\textrm{Ag}^+]=[\textrm{CH}_3\textrm{COO}^-]+[\textrm{CH}_3\textrm{COOH}]=[\textrm{CH}_3\textrm{COO}^-].\bigg(1+\frac{\textrm h}{K_a}\bigg)\)
donc \([\textrm{CH}_3\textrm{COO}^-]=\frac{s}{\bigg(1+\frac{\textrm h}{K_a}\bigg)}\) et \(K_s=[\textrm{Ag}^+].[\textrm{CH}_3\textrm{COO}^-]=\frac{s^2}{\bigg(1+\frac{\textrm h}{K_a}\bigg)}=2.10^{-3}\)
soit \(s=\sqrt{K_s.\bigg(1+\frac{\textrm h}{K_a}\bigg)}\)
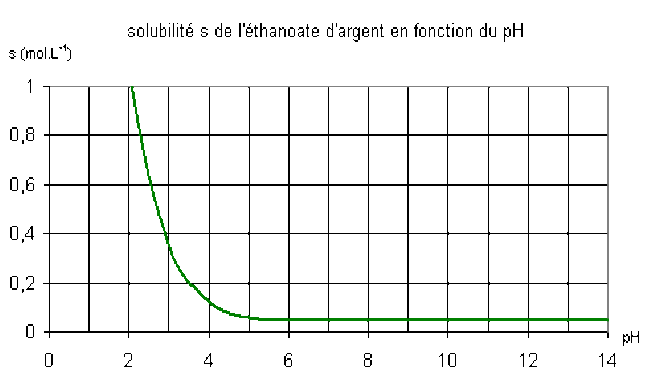
Comme on peut le constater sur le graphique ci-dessus, la solubilité de ce sel est bien plus importante en milieu acide ; on observera donc la redissolution d'un précipité d'éthanoate d'argent en ajoutant de l'acide nitrique au milieu .
Exemple : 2. Solubilité du sulfure de manganèse MnS en fonction du pH
Le problème présente beaucoup d'analogies avec la dissolution de l'éthanoate d'argent, la différence essentielle se situant dans le fait que l'ion sulfure \(\textrm S^{2-}\) est une dibase.
Le solide se dissocie en ions sulfure (dibase faible) et manganèse (sans propriété acido-basique dans l'eau) :
\(\textrm{MnS}_{(s)}\rightleftarrows\textrm{ S}^{2-}+\textrm{Mn}^{2+}\textrm{ }K_1=K_s=10^{-\textrm{9,6}}\)
Dans l'eau, la base \(\textrm S^{2-}\) va à son tour réagir :
\(\textrm{S}^{2-}+\textrm H_2\textrm O\rightleftarrows\textrm{ HS}^-+\textrm{OH}^-\textrm{ }K_2=\frac{K_e}{K_{a2}}=10^{-\textrm{1,1}}\)
\(\textrm{HS}^-+\textrm H_2\textrm O\rightleftarrows\textrm{ H}_2\textrm S+\textrm{OH}^-\textrm{ }K_3=\frac{K_e}{K_{a1}}=10^{-7}\)
Un raisonnement analogue à celui effectué au paragraphe précédent pour l'éthanoate d'argent conduit aux relations
\(s=[\textrm{Mn}^{2+}]=[\textrm S^{2-}]+[\textrm{HS}^-]+[\textrm H_2\textrm S]=[\textrm S^{2-}].\bigg(1+\frac{\textrm h}{K_{a2}}+\frac{\textrm h^2}{K_{a1}.K_{a2}}\bigg)\)
soit \(s=\sqrt{K_s.\bigg(1+\frac{\textrm h}{K_{a2}}+\frac{\textrm h^2}{K_{a1}.K_{a2}}\bigg)}\)
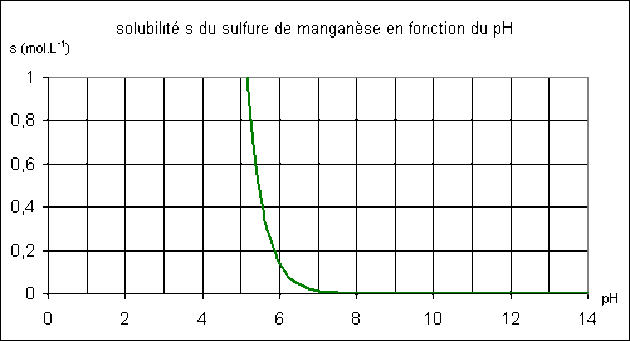
Dans de nombreux cas, des réactions de complexation peuvent également se produire, comme par exemple dans le cas de nombreux hydroxydes ; la solubilité des hydroxydes sera étudiée au paragraphe suivant.