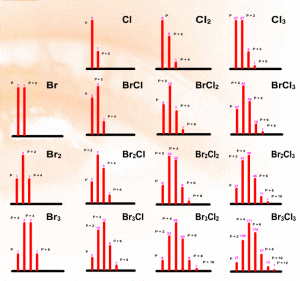
Combinaisons isotopiques
Concernant les pics parents des composés halogénés, on doit prendre en compte la composition des différents amas isotopiques pour bien évaluer la masse des fragments neutres perdus séparant les divers ions. Il va de soi que le pic P n'est porteur que d'isotopes légers et que le P + 2n pour n\(\textrm{Cl}\) et/ou n\(\textrm{Br}\), est le plus lourd et n'est constitué que d'isotopes lourds. Il y a deux approches pour évaluer les combinaison isotopiques du chlore et/ou du brome :
une approche simple qui ne se base que sur l'écart de masse de 2u entre isotopes, commun au \(\textrm{Cl}\) et au \(\textrm{Br}\) en prenant la lettre l pour l'isotope léger et L pour l'isotope lourd, ou développe l'expression (\(\frac{1}{2}\)l + \(\frac{1}{2}\) L)nBr (\(\frac{3}{4}\)l + \(\frac{1}{4}\) L)nCl dans laquelle \(n\textrm{Br}\) est le nombre de \(\textrm{Br}\) et \(n\textrm{Cl}\) le nombre de \(\textrm{Cl}\). Appliqué à \(\textrm{Br}_3\textrm{Cl}\) par exemple, on arrive à
(\(\frac{1}{2}\)l+\(\frac{1}{2}\)L)3*(\(\frac{3}{4}\) l+\(\frac{1}{4}\) L) = (NB : il est inutile de prendre en compte les dénominateurs à moins que l'on souhaite vérifier les calculs)
(l3 + 3l2L + 3lL2 + L3) * (3l + 1L) =
3l*l3 + 3l*3l2L + 3l*3lL2 + 3l*L3 + Ll3 + 3Ll 2L + 3LlL2 + LL3 =
3l4 + 10l3L + 12l2L2 + 6lL3 + L4
l4 représente la contribution de quatre isotopes légers donc P,
l3L voit le remplacement d'un l par un L, soit P + 2,
l2L2 voit le remplacement de deux l par deux L, soit P + 4,
lL3 voit le remplacement de trois l par trois L, soit P + 6, et
L4 représente 4 isotopes lourds L, soit P + 8.
On va donc observer les 5 pics P / P + 2 / P + 4 / P + 6 / P + 8 dans le rapport 3 / 10 / 12 / 6 / 1.
Remarque :
La somme de ces facteurs donne 32 et que les dénominateurs négligés sont (\(\frac{1}{2}\))3*(\(\frac{1}{4}\)) soit (\(\frac{1}{8}\))*(\(\frac{1}{4}\)) = \(\frac{1}{32}\). Ramenées à leur dénominateur commun, l'ensemble des intensités relatives est de \(\frac{32}{32}\) soit 1, probabilité d'avoir la molécule.
une approche plus lourde consiste à engager la discussion de la même manière mais à différentier les deux types d'atomes, c'est à dire à développer l'équation précédente en conservant les apports de chaque type d'halogène
\((\frac{1}{2} \textrm{Br}\textrm{}^{79}+ \frac{1}{2} \textrm{Br}^{81})\textrm{}^{n\textrm{Br}}( \frac{3}{4}\textrm{Cl}^{35} + \frac{1}{4} \textrm{Cl}^{37})^{n\textrm{Cl}}\)
dans laquelle \(n\textrm{Br}\) est le nombre de \(\textrm{Br}\) et \(n\textrm{Cl}\) le nombre de \(\textrm{Cl}\). Appliqué à \(\textrm{Br}_3\textrm{Cl}\) par exemple, on arrive à
\((\frac{1}{2}\textrm{Br}^{79}+ \frac{1}{2}\textrm{Br}^{81})^3*(\frac{3}{4}\textrm{Cl}^{35} + \frac{1}{4}\textrm{Cl}^{37})\) = (NB : il est inutile de prendre en compte les dénominateurs à moins que l'on souhaite vérifier les calculs)
\([(\textrm{Br}^{79})^3+ 3(\textrm{Br}^{79})^2(\textrm{Br}^{81}) + 3(\textrm{Br}^{79})(\textrm{Br}^{81})^2 + (\textrm{Br}^{81})^3]*(3\textrm{Cl}^{35}+ \textrm{Cl}^{37}) =\)
\(3\textrm{Cl}^{35}(\textrm{Br}^{79})^3+ 3*3\textrm{Cl}^{35}(\textrm{Br}^{79})^2(\textrm{Br}^{81}) + 3*3\textrm{Cl}^{35}(\textrm{Br}^{79})(\textrm{Br}^{81})^2 + 3\textrm{Cl}^{35}(\textrm{Br}^{81})^3 + \textrm{Cl}^{37}(\textrm{Br}^{79})^3 + 3\textrm{Cl}^{37}(\textrm{Br}^{79})^2(\textrm{Br}^{81}) + 3\textrm{Cl}^{37}(\textrm{Br}^{79})(\textrm{Br}^{81})^2 + \textrm{Cl}^{37}(\textrm{Br}^{81})^3\)
On obtient :
P intensité 3 avec \(3\textrm{Cl}^{35}(\textrm{Br}^{79})^3\), soit \(3\textrm{Br}^{79}\) pour \(1\textrm{Cl}^{35}\),
P + 2 intensité 10 avec \(9\textrm{Cl}^{35}(\textrm{Br}^{79})^2(\textrm{Br}^{81})\) et \(1 \textrm{Cl}^{37}(\textrm{Br}^{79})^3\),
P + 4 intensité 12 avec \(9\textrm{Cl}^{35}(\textrm{Br}^{79})(\textrm{Br}^{81})^2\) et \(3 \textrm{Cl}^{37}(\textrm{Br}^{79})^2(\textrm{Br}^{81})\),
P + 6 intensité 6 avec \(3\textrm{Cl}^{35}(\textrm{Br}^{81})^3\) et \(3 \textrm{Cl}^{37}(\textrm{Br}^{79})(\textrm{Br}^{81})^2\),
P + 8 intensité 1 avec \(3 \textrm{Cl}^{37}(\textrm{Br}^{81})^3\), soit \(3\textrm{Br}^{81}\) pour \(1 \textrm{Cl}^{37}\).
L'intérêt de cette décomposition est de montrer que dès le pic P + 2, des isotopes lourds peuvent être présents issus des différents types d'halogènes.
Évaluer des fragments neutres perdus à partir d'un P + 2 ou P + 2x, n'est pas sans risque vu la complexité de leur composition. Il est donc recommandé de travailler sur le pic P et sur des fragments, dont ont aura auparavant évalué la composition isotopique (conservation de tout ou partie des halogènes) en retenant le fragment constitué des isotopes légers (descendant de P) avant l'affirmation d'une perte significative !
Les fonctions halogénées ont été en grande partie décrites précédemment :
Concernant les mécanismes, nous avons vu que la compétition entre les deux coupures des liaisons en \(\alpha\) et \(\beta\) en de l'hétéroatome sera marquée par la taille de l'atome et son électronégativité pour la coupure de la liaison la plus proche, avec une préférence aux gros atomes électronégatifs. Voici cequ'il a été dit :
La compétition entre les deux coupures des liaisons en alpha et bêta de l'hétéroatome sera marquée :
par la taille de l'atome et son électronégativité pour la coupure de la liaison la plus proche, avec préférence aux gros atomes électronégatifs (\(\textrm{Cl}\), \(\textrm{Br}\), \(\textrm{I}\)) qui conduisent à une coupure et à la présence de l'hétéroatome sur le fragment non chargé
par l'effet donneur de l'hétéroatome conduisant à la coupure de la liaison suivante, avec préférence à l'azote, la charge étant conservée sur le fragment contenant l'hétéroatome.
Les atomes intermédiaires participent aux deux types de coupures.
Exemple :
Ainsi pour le bromure de butyle, les ions prépondérants, dont le pic de base à m / z = 57, sont des fragments alkyles. Les quelques ions bromés facilement identifiés sous forme de "doublets" séparés par 2 u sont d'intensités relatives très faibles. On observe une prédominance de la coupure avec présence de la charge sur R.
Concernant le chlore et le brome, nous avons vu l'importance des isotopes lourds qui abondent des P + 2 importants... Nous ne développons pas à nouveau cet aspect dans ce chapitre mais rappelons qu'une étude précise des fragments perdus successifs nécessite l'identification des différents isotopomères.
Compte tenu de la tendance marqué des chlores et bromes à déplacer la liaison en \(\alpha\) vers leur déficit de charge, l'halogène est souvent dans le fragment non chargé, ce qui réduit les possibilités d'observations des combinaisons isotopiques ; seuls les composés disposant d'autres atomes ou fragments moléculaires susceptibles de stabiliser la charge (par exemple les aromatiques) présentent des pics moléculaires suffisamment intenses pour explorer avec précision les combinaisons isotopiques.
Le fluor sur des chaînes saturées a un comportement identique et il est difficile de trouver des exemple présentant un pic moléculaire acceptable. On observe donc plutôt des P - X, soit des P - 19 pour \(\textrm F\), P - 35 (et P + 2 - 37) pour \(\textrm{Cl}\) ou P - 79 (ou P + 2 - 81) pour \(\textrm{Br}\). Dans certains cas, on observe aussi des P - XH par exemple P - 20 pour la perte de \(\textrm{HF}\) (fragment spécifique).
Les coupures \(\beta\) sont d'autant plus importantes que l'halogène est donneur soit F > Cl > Br > I. Cet effet très important dans le cas du fluor est à l'origine de coupure \(\beta\) affectant un liaison \(\textrm{C-H}\) et à l'origine de P - 1 inattendu. Les ions classiques sont de type \(\textrm H_2\textrm{C=X}^+\) ou \(\textrm{HRC=X}^+\) avec pour le fluor, l'ion 33.
Les dérivés bromés ou iodés se prêtent à des réarrangements inattendus (cycles à 3 atomes incluant l'halogène chargé) tel \(\textrm C_2\textrm H_4\textrm{Br}^+\).