Le théorème de Koopman
Considérons le modèle du champ moyen. Dans ce modèle, les énergies des orbitales ne s'ajoutent pas et ne sont donc pas à priori utilisables pour comparer plusieurs configurations électroniques.
Néanmoins, on peut montrer que l'énergie d'une orbitale issue d'un calcul de champ moyen donne en bonne approximation l'énergie nécessaire pour arracher l'électron qui occupe cette orbitale, en le portant au niveau d'énergie orbitalaire nulle.
L'énergie d'une orbitale en valeur absolue donne l'énergie d'ionisation correspondante.
Ce résultat est connu sous le nom de "Théorème de Koopman".
Une approximation très satisfaisante de l'énergie de première ionisation d'un atome peut être ainsi directement obtenue à partir de l'énergie de la dernière orbitale occupée. Inversement, la connaissance de l'énergie de première ionisation permet de positionner la dernière orbitale occupée sur un schéma énergétique.
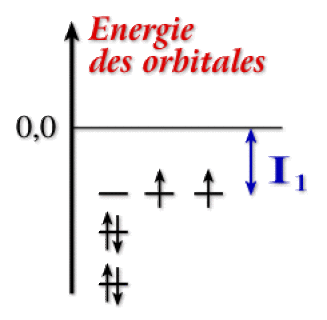
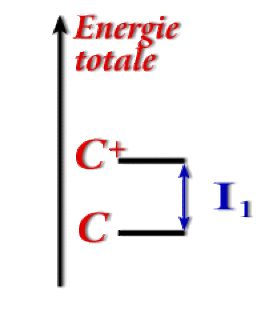
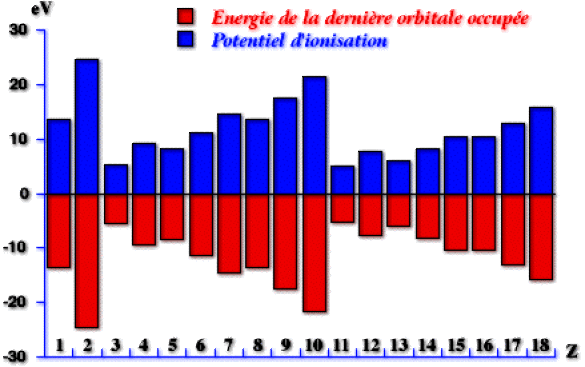
La figure ci-dessus rassemble les énergies expérimentales de première ionisation et les énergies calculées théoriquement des orbitales les plus hautes occupées pour les éléments des trois premières périodes de la classification. La symétrie quasi-parfaite de la figure reflète la validité du théorème de Koopman.
Ce théorème est d'une importance fondamentale : il permet de baser une grande partie de l'interprétation des propriétés électroniques des éléments sur le spectre énergétique des orbitales, sans avoir à considérer l'énergie totale des atomes.