Loi de variation
Le potentiel d'ionisation varie dans le sens opposé au rayon atomique, ce qui est facilement concevable : plus le nuage électronique est étendu, plus il est facile d'arracher un électron de la couche externe qui se trouve moins lié par l'attraction nucléaire, et par conséquent, plus l'énergie nécessaire est faible. Ainsi, l'énergie d'ionisation augmente dans l'ensemble suivant les périodes de la classification, et diminue suivant les colonnes.
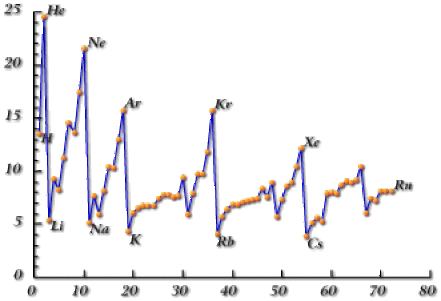

On remarque que l'augmentation de l'énergie d'ionisation, de gauche à droite du tableau, est relativement régulière dans un même groupe (blocs \(\textrm s\), \(\textrm p\) ou \(\textrm d\)).
Le passage du bloc \(\textrm d\) au bloc \(\textrm p\) se traduit cependant par une chute de l'énergie d'ionisation. Dans les éléments de transition en effet, les électrons externes de type \(n\textrm s\) subissent un écran faible de la part des électrons \((n-1)\textrm d\) qui appartiennent aussi à la couche de valence. Cet écran affaibli conduit à une stabilisation de l'énergie de l'orbitale et une augmentation corrélative de l'énergie d'ionisation correspondant au départ de ces électrons \(n\textrm s\). On peut faire le parallèle avec l'augmentation du rayon atomique que l'on observe entre le bloc \(\textrm d\) et le bloc \(\textrm p\).