Loi de variation
La variation de l'affinité électronique est globalement similaire à celle de l'énergie d'ionisation. Sauf exceptions, l'affinité électronique augmente de gauche à droite le long des périodes de la classification, comme le montre la figure ci-dessous (les énergies sont exprimées en eV) :
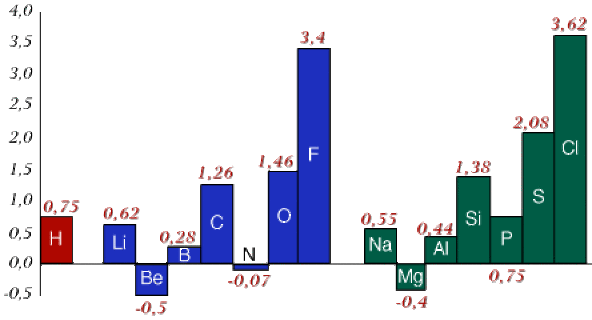
Dans le cas du bérylium et du magnésium la sous-couche \(n\textrm s\) est complète (\(\textrm{Be} : 2\textrm s^2 \textrm{et} \textrm{Mg} : 3\textrm s^2\)). Il faudrait fournir beaucoup d'énergie pour ajouter un électron sur la sous-couche supérieure, ce qui induit une affinité électronique négative.
Les éléments à sous-couche demi-pleine comme l'azote (\(\textrm N : 2\textrm p^3\)) ou le phosphore (\(\textrm P : 3\textrm p^3\)) ont une affinité électronique faible. L'ajout d'un électron supplémentaire fait perdre la stabilisation dûe au demi-remplissage de la sous-couche.