Etablissement de schémas de Lewis
Partie
Question
Etablir les schémas de Lewis principaux de l'ion\( \mathrm{NO}_3^-\) et de la molécule \(\mathrm{SO}_3\).
Aide simple
L'oxygène est plus électronégatif que l'azote et le soufre.
Il faut faire en sorte de traiter les liaisons équivalentes de la même manière. On doit donc s'assurer de la présence des structures résonantes nécessaires.
S'il y a trop de schémas résonants pour les dessiner raisonnablement, on indique juste qu'on doit les prendre en compte.
Aide méthodologique
On commence par établir le nombre d'électrons de valence de chaque atome.
On affecte les électrons supplémentaires aux atomes les plus électronégatifs.
On établit un schéma préliminaire en complétant la couche de valence des atomes périphériques des deux premières lignes (ici les oxygènes).
On vérifie éventuellement si la règle de l'octet est vérifiée sur les autres atomes.
Si certains atomes dépassent l'octet, on transfère des paires liantes vers les atomes les plus électronégatifs. On abaisse ainsi la population atomique des atomes surpeuplés en ne modifiant pas l'octet des atomes environnants.
Dans le cas d'atomes appartenant aux lignes inférieures de la classification, on peut envisager de dépasser l'octet. Dans le cas des éléments de la troisième ligne du bloc p, il est cependant indiqué de présenter toutes les structures résonantes jusqu'à vérification de la règle de l'octet.
Aide à la lecture
On demande d'explorer toutes les structures de Lewis compatibles avec la structure électronique des atomes.
Solution détaillée
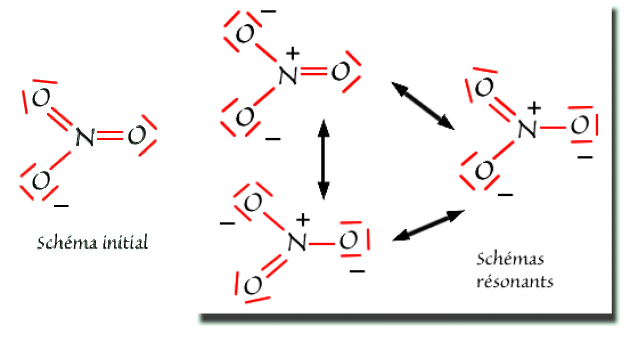
Pour l'ion\( \mathrm{NO}_3^-\), les schémas de Lewis sont représentés ci-dessous.
Les trois atomes appartenant à la seconde ligne, il n'y a pas d'ambiguïté quant au respect de la règle de l'octet.
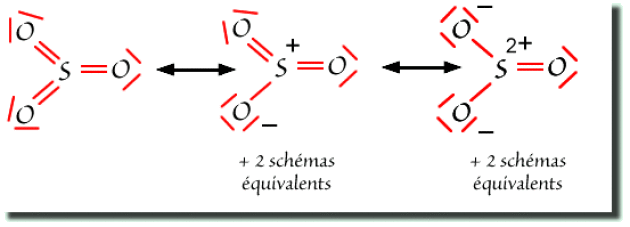
Pour la molécule \(\mathrm{SO}_3\), les schémas de Lewis sont plus nombreux. On a représenté ci-dessous les schémas types. Les autres schémas résonants s'obtiennent par rotation des liaisons.
Dans ce cas, on est amené à proposer une structure sans charges partielles dans laquelle le soufre partage plus de huit électrons, ainsi que des structures dites " ioniques " obtenues par transfert de paires liantes vers l'oxygène.