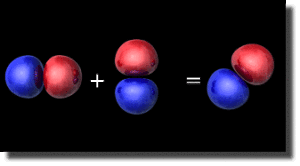
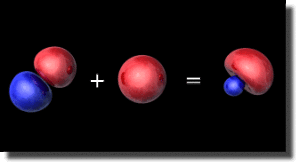
Le mélange s-p-p
Pour une figure de répulsion triangulaire (dans le plan \(x\textrm Oy\)), la polarisation par les ligandes se reflète sur trois orbitales de valence. On traduit cette polarisation en introduisant trois orbitales appelées hybrides \(\textrm{sp}^2\). Ces trois hybrides sont simulées par des combinaisons linéaires normées de l' orbitale \(2\textrm s\), de l'orbitale \(2\textrm p_x\) et de l'orbitale \(2\textrm p_y\). Elles remplacent les orbitales \(2\textrm s\) et \(2\textrm p_x\) et \(2\textrm p_y\).
Ce type d'hybridation se rencontre pour les atomes de type \(\textrm{AX}_3\), \(\textrm{AX}_2\textrm E\) et \(\textrm{AXE}_2\).
L'angle d'hybridation entre les deux orbitales \(2\textrm p\) correspond aussi à l'angle d'orientation de l'orbitale résultante. On a représenté ci-dessus un mélange égal des deux orbitales \(2\textrm p\) (angle d'hybridation de 45°). L'axe de révolution de la résultante fait donc un angle de 45° avec les axes \(\textrm Ox\) et \(\textrm Oy\).
On combine alors l'hybride \(\textrm p^2\) avec l'orbitale \(2\textrm s\). Un autre angle d'hybridation intervient, qui règle le poids relatif de la composante \(2\textrm s\) par rapport à celui de la composante \(2\textrm p\) orientée. Cette hybridation dépend de la nature des interactions et donc de la nature des atomes en présence.
On obtient ainsi une orbitale hybride \(\textrm{sp}^2\) qui possède l'allure caractéristique d'une hybride \(\textrm{sp}\) mais peut s'orienter en dehors des axes \(\textrm Ox\) et \(\textrm Oy\), en fonction de l'angle de mélange entre orbitales \(2\textrm p\).
Là encore, pour pouvoir représenter les trois hybrides sur le même atome, on adopte une représentation symbolique allongée similaire à celle vue précédemment pour les hybrides \(\textrm{sp}\).