L'éthylène
Dans l'éthylène, les deux atomes de carbone sont de type \(\textrm{AX}_3\). Ils sont hybridés \(\textrm{sp}^2\). Les hybrides forment trois liaisons \(\sigma\) axiales \(\textrm C-\textrm C\) et \(\textrm C-\textrm H\). Les deux orbitales \(2\textrm p\) portent un électron chacune et forment une liaison \(\pi\).
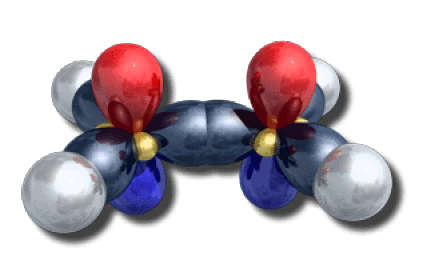
Schéma d'hybridation dans l'éthylène
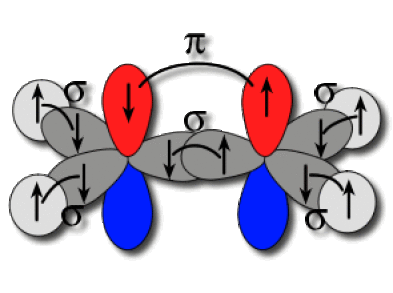
L'existence de la liaison \(\pi\) et la planéité de la molécule vont de pair. Pour que la liaison double s'établisse, il faut que les orbitales soient positionnées de manière adaptée, ce qui impose la coplanarité des liaisons.
L'hybridation \(\textrm{sp}^2\) est typique des environnements plans.