Les oxydes de soufre
Durée : 10 mn
Note maximale : 6
Question
Comparer l'état d'hybridation du soufre dans les espèces\(\textrm{SO}_{2}\),\(\textrm{SO}_{3}\)et\(\textrm{SO}_{4}^{2-}\). On ne considérera pas les structures hypervalentes du soufre.
Solution
Les schémas de Lewis sont donnés ci-dessous. Ils permettent de déterminer les types VSEPR de l'atome de soufre.
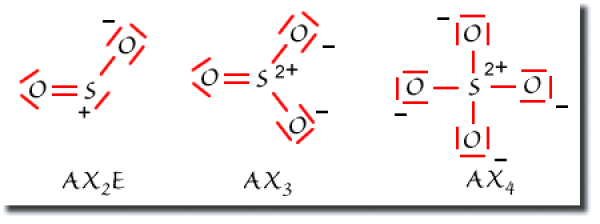
Dans\(\textrm{SO}_{2}\), le soufre est de type\(\textrm{AX}_{2}\textrm{E}_{2}\). La figure de répulsion est tétraédrique. Il est alors dans un état d'hybridation\(\textrm{sp}^{3}\).
Dans\(\textrm{SO}_{3}\), le soufre est de type\(\textrm{AX}_{3}\textrm{E}\). La figure de répulsion est tétraédrique. Il est alors dans un état d'hybridation\(\textrm{sp}^{3}\).
Dans\(\textrm{SO}_{4}^{2-}\), le soufre est de type\(\textrm{AX}_{4}\). La figure de répulsion est tétraédrique. Il est alors dans un état d'hybridation\(\textrm{sp}^{3}\).