Déviations à la loi des gaz parfaits
Lors de la mesure très précise du produit \(\mathrm{P.V}\) à différentes pressions et à température fixée, on observe des variations illustrées par la figure ci-dessous :
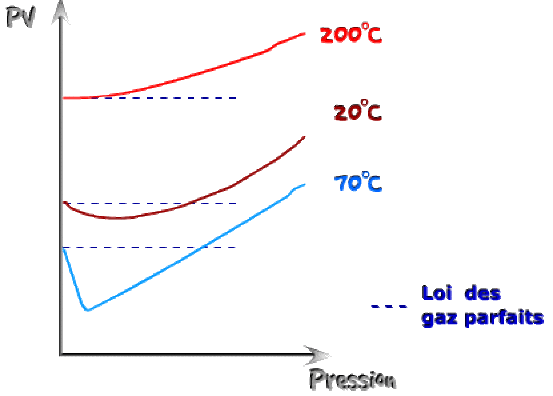
La variation du produit \(\mathrm{P.V}\) dépend de la température. L'écart à la loi des gaz parfaits est d'autant plus grand que la pression est élevée. On peut modéliser cette dépendance par le développement suivant :
\(\mathbf{P.V_m=\textrm R.T+\textrm b.P+\textrm c.P^2+...}\)
Cette équation d'état empirique est fréquemment appelée équation du viriel. Les coefficients du viriel \(\textrm b, \textrm c,\) ... dépendent de la nature chimique du gaz envisagé. On peut les obtenir par ajustement aux mesures expérimentales.