Structure du chlorure de lithium
Partie
Question
Le chlorure de lithium LiCl cristallise dans le système cfc avec un paramètre de maille \(\mathrm{a}=5,14~\AA\). D'après les deux schémas ci-dessous, qui représentent 2 hypothèses de structure, calculer le rayon ionique du chlore et dire quelle est la représentation exacte de la maille sachant que le rayon ionique du lithium vaut\( 0,68~\AA\).
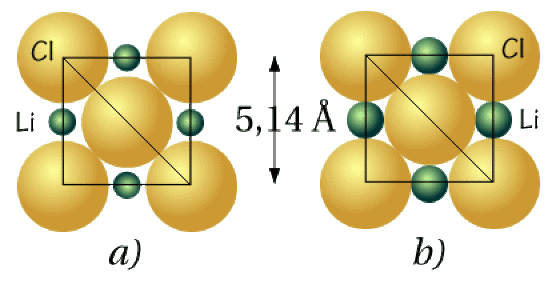
Calculer la masse volumique de LiCl.
On donne :
Masse molaire : \(\mathrm{M_{LiCl} = 42,5~g.mol^{-1}}\)
Nombre d'Avogadro : \(\mathrm{N = 6,02.10^{23}~mol^{-1}}\)
Aide simple
Les anions chlorures sont tangents dans les deux cas.
On rappelle la formule bien connue de la masse volumique :
\(\rho=\mathrm{\frac{ZM}{NV}}\)
où V est le volume de la maille (en \(\mathrm{cm^3}\)) et M est la masse molaire du groupement formulaire (en \(\mathrm{g.mol^{-1}}\)).
Aide méthodologique
On choisit de tester l'hypothèse b) car dans ce cas, les ions \(\mathrm{Li}^+\) et \(\mathrm{Cl}^-\) sont tangents. On peut alors extraire la valeur du rayon de \(\mathrm{Li}^+\) dans ce cas.
Solution détaillée
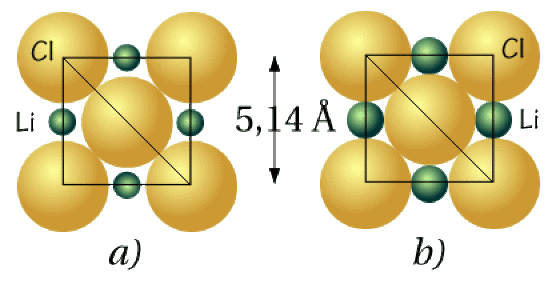
Les ions chlorures sont tangents sur la diagonale d'une face du cube de longueur \(\mathrm{a\sqrt{2}=4R_{Cl^-}}\)
Le rayon ionique du chlore est donc :
\(\mathrm{R_{Cl^-}=\frac{\sqrt2}{4}a=1,82\AA}\)
On peut alors calculer la taille maximale de l'ion \(\mathrm{Li}^+\) qui s'insère entre les ions chlorures (hypothèse b).
\(\mathrm{a=2R_{Cl^-}+2R_{Li^+}}\)
\(\mathrm{R_{Li^+}=\frac{a-2R_{Cl^-}}{2}}=\frac{5,14-(2\times1,82)}{2}=0,75\AA\)
Cette valeur est supérieure au rayon ionique du lithium. Ce dernier n'est donc pas tangent aux anions chlorures et c'est le schéma a) qui est exact.
Dans la maille cfc, le nombre de groupement formulaires LiCl est Z = 4 .
Il vient alors :
\(\rho=\mathrm{\frac{ZM}{NV}=\frac{4\times42,5}{6,02.10^{23}\times\left(5,14.10^{-8}\right)^3}}=2,08~\mathrm{g.cm^{-3}}\)