Cinétique d'oxydation
Partie
Question
On réalise l'oxydation des ions iodures \(I^{-}\) par les ions péroxodisulfate \(S_{2}O_{8}^{2−}\) suivant les conditions de concentration et de températures suivantes :
Expérience n° | \([I^{-}]\) \((10^{-2} \textrm{mol .l}^{-1})\) | \([S_{2}O_{8}^{2-}]\) \((10^{-2} \textrm{mol .l}^{-1})\) | Température | Catalyseur |
1 | 2 | 1 | 20 | |
2 | 4 | 2 | 20 | |
3 | 2 | 1 | 35 | |
4 | 4 | 2 | 35 | |
5 | 2 | 1 | 20 | quelques gouttes de sulfate de Fe III |
Donner l'équation-bilan de la réaction d'oxydation.
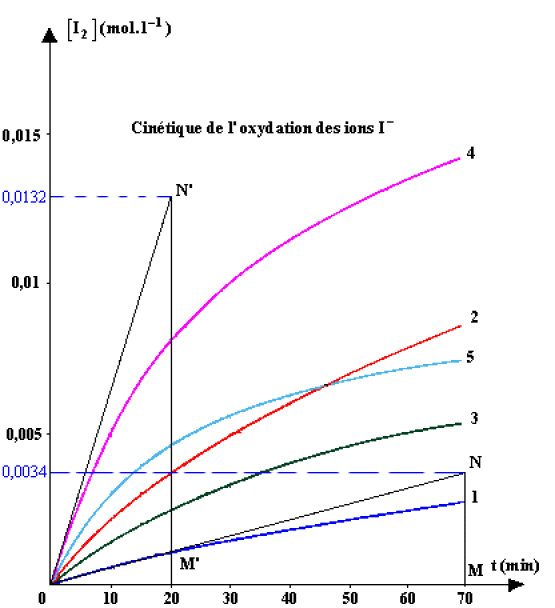
A partir de la représentation graphique de la cinétique de l'oxydation des ions iodures \(I^{-}\) par les ions péroxodisulfates \(S_{2}O_{8}^{2−}\), déterminer les valeurs des vitesses instantanées pour les expériences 1 et 4 ( Nous avons représenté les tangentes à l'origines des courbes 1 et 4).
Aide simple
Compléter l'équation - bilan :
\(S_{2}O_{8}^{2−} + 2I^{-} \rightleftarrows\)
Aide détaillée
La vitesse instantanée, à \(t = 0\), est reliée à la pente de la tangente à l'origine de la courbe représentative de la cinétique de la réaction d'oxydation.
Solution simple
Par graphique, nous obtenons :
pour l'expérience 1 : \(v_1 = \mathrm{4,86} \cdot 10^{-5} \textrm{ mole.min }^{-1}\)
pour l'expérience 4 : \(v_2 = \mathrm{6,6} \cdot 10^{-4} \textrm{ mole.min }^{-1}\)
Solution détaillée
L'équation-bilan de la réaction s'écrit :
\(S_{2}O_{8}^{2−} + 2I^{-} \rightleftarrows I_{2} + 2 {SO}_{4}^{2-}\)
Si \(\Delta x\) représente le nombre de moles d'iode \(I_2\), formé pendant le temps \(\Delta t\), la vitesse moyenne de la réaction est définie par \(v_{m} = \frac{\Delta x}{\Delta t}\) et la vitesse instantanée par \(v_ = \frac{\Delta x}{\Delta t}= \displaystyle{\lim_{\Delta t \to 0} \frac{\Delta x}{ \Delta t}}\).
La méthode graphique de détermination de v consiste à mesurer la pente de la tangente à l'origine de la courbe représentative de la cinétique de réaction.
Pour l'expérience 1 :
\(v_{1} = \frac{dx}{dt} = \frac{MN}{OM} = \frac{\mathrm{2,4} \cdot 10^{-3}}{70} =\mathrm{4,86} \cdot 10^{-5} \textrm{ mole.min }^{-1}\)
Pour l'expérience 4 :
\(v_{4} = \frac{dx}{dt} = \frac{M'N'}{OM'} = \frac{\mathrm{1,32} \cdot 10^{-2}}{20} = v_2 = \mathrm{6,6} \cdot 10^{-4} \textrm{ mole.min }^{-1}\)
Question
On rappelle le tableau des expériences :
Expérience n° | \([I^{-}]\) \((10^{-2} \textrm{mol .l}^{-1})\) | \([S_{2}O_{8}^{2-}]\) \((10^{-2} \textrm{mol .l}^{-1})\) | Température | Catalyseur |
1 | 2 | 1 | 20 | |
2 | 4 | 2 | 20 | |
3 | 2 | 1 | 35 | |
4 | 4 | 2 | 35 | |
5 | 2 | 1 | 20 | quelques gouttes de sulfate de Fe III |
A partir des cinq expériences ci-dessus, déterminer l'influence des facteurs "concentration, "température" et "catalyseur" sur la cinétique de la réaction.

Aide simple
Comparer les expériences entre elles, en fonction du seul facteur qui diffère.
Pour la concentration, voir par exemple les expériences 1 et 2.
Pour la température, voir les expériences 1 et 3.
Pour le catalyseur, trouver celle à associer à l'expérience 5.
Aide détaillée
A comparer (1 et 2) ou (3 et 4) pour la concentration puis (1 et 3) ou (2 et 4) pour la température, enfin (1 et 5) pour le catalyseur.
Solution détaillée
Influence des différents facteurs
La concentration :
comparons les expériences (1 et 2) ou (3 et 4).
Pour la même température, les concentrations sont doubles dans l'expérience 2 (ou 4).
La vitesse de réaction est une fonction de la concentration des produits en présence.
Vérification expérimentale :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
La température :
Comparons les expériences (1 et 3) ou (2 et 4).
Pour les mêmes concentrations, (1 et 3) ou (2 et 4), l'élévation de température favorise l'augmentation de la vitesse de réaction.
Vérification expérimentale :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Le catalyseur :
Comparons les expériences (1 et 5).
Pour une même température et même concentration, la présence de sulfate de Fe III, accélère la vitesse de réaction.
Vérification expérimentale
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Question
On donne les potentiels normaux d'oxydoréduction des couples suivants :
\(S_{2}O_{8}^{2-}/{SO}_{4}^{2-}\) | \(E = \mathrm{2,01} \textrm{ volts}\) |
\(I_{2}/I-\) | \(E = \mathrm{0,54} \textrm{ volts}\) |
\({Fe}^{3+}/{Fe}^{2+}\) | \(E = \mathrm{0,77} \textrm{ volts}\) |
Interpréter le rôle catalytique des ions \({Fe}^{2+}\) dans la réaction d'oxydoréduction des ions iodures par les ions péroxodisulfate.
Aide simple
Classer ces trois couples en fonction de leur potentiel d'oxydoréduction.
Voir les réactions d'oxydation possibles pour ces trois couples d'oxydoréduction.
Aide détaillée
Compléter les réactions d'oxydation :
(I) : \(S_{2}O_{8}^{2-} + 2 I^{-} \to\)
(II) : \(S_{2}O_{8}^{2-} + 2 Fe^{2+} \to\)
(III) : \(2 {Fe}^{3+} + 2 I^{-} \to\)
et remarquer que (I) = (II) + (III)
Solution simple
Classer les 3 couples en fonction de leur potentiel d'oxydoréduction décroissant.
Tout oxydant de potentiel \(E_1\) oxyde un réducteur de potentiel \(E_2 < E_1\).
Réactions d'oxydoréduction :
(I) : \(S_{2}O_{8}^{2-} + 2 I^{-} \to 2 {SO}_{4}^{2-} + I_{2}\)
(II) : \(S_2O_{8}^{2-} + 2 Fe^{2+} \to 2 {SO}_{4}^{2-} + 2 Fe^{3+}\)
(III) : \(2 Fe^{3+} + 2 I^{-} \to 2 {Fe}^{2+} + I_{2}\)
Nous avons l'égalité (I) = (II) + (III). Ces deux dernières réactions entre ions de signes contraires entrent plus rapidement en réaction alors que la réaction (I) entre ions de même signe et dont la répulsion électrostatique ne favorise pas le transfert électronique par l'oxydoréduction.
Solution détaillée
En classant les trois couples suivant les valeurs décroissantes de leur potentiel d'oxydoréduction on a :
\(S_{2}O_{8}^{2-}/{SO}_{4}^{2-}\) | \(E = \mathrm{2,01} \textrm{volts}\) |
\({Fe}^{3+}/{Fe}^{2+}\) | \(E = \mathrm{0,77} \textrm{ volts}\) |
\(I_{2}/I^{-}\) | \(E = \mathrm{0,54} \textrm{ volts}\) |
L'oxydant d'un couple de potentiel \(E_1\) oxyde le réducteur d'un autre couple de potentiel \(E_2 < E_1\). On obtient les cas possibles :
(I) : \(S_{2}O_{8}^{2-} + 2 I^{-} \to 2 {SO}_{4}^{2-} + I_{2}\)
(II) : \(S_2O_{8}^{2-} + 2 Fe^{2+} \to 2 {SO}_{4}^{2-} + 2 Fe^{3+}\)
(III) : \(2 Fe^{3+} + 2 I^{-} \to 2 {Fe}^{2+} + I_{2}\)
La réaction (I) est le résultat de la somme des réactions (II) et (III).
Montrons que les réactions (II) et (III) sont plus rapides que la réaction (I). En effet, la réaction (I) est une réaction entre ions chargés négativement et une certaine répulsion électrostatique freine le transfert électronique pour l'oxydoréduction. Les réactions (II) et (III) sont des réactions entre ions dont les charges sont de signes contraires : l'attraction des charges favorise la rencontre et l'oxydoréduction est plus rapide que pour la réaction (I).
Question
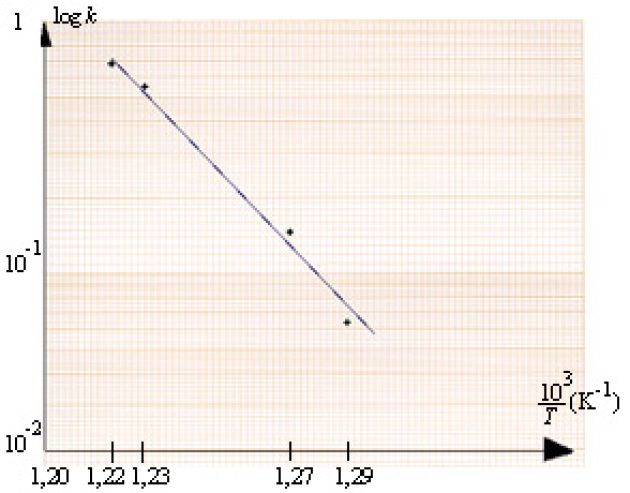
La constante de vitesse \(k\) pour la réaction \(S_{2}O_{8}^{2-} + 2I^{-} \rightleftarrows I_{2} + 2{SO}_{4}^{2-}\) est mesurée en fonction de la température Kelvin.
\(T(K)\) | \(770\) | \(790\) | \(810\) | \(830\) |
\(k\) | \(\mathrm{0,064}\) | \(\mathrm{0,15}\) | \(\mathrm{0,55}\) | \(\mathrm{0,68}\) |
On a porté sur du papier "semi-log" les points expérimentaux (\(\log k\) en ordonnée et \(10^{3}/T\) en abscisse). Peut-on prévoir la forme de la fonction \(k = f (1/T)\) ? Calculer l'énergie d'activation \(E_a\) et en déduire la constante \(A\) de la relation d'Arrhenius.
Aide simple
L'obtention d'une droite en papier "semi-log" suggère la forme de la fonction \(k = f(1/T)\).
La loi d'Arrhenius est de la forme :
\(k = A \exp \left(-\frac{E_{a}}{RT}\right)\)
Aide détaillée
Le calcul de l'énergie d'activation s'obtient à partir de deux couples de valeurs \((k,T)\).
Solution simple
Pour deux couples \((k_{1},T_{1})\) et \((k_{2},T_{2})\), l'énergie d'activation sera :
\(-\frac{E_{a}}{R} = \frac{T_{1}T_{2}}{T_{1} - T_{2}} \ln \frac{k_{2}}{k_{1}}\)
et \(E_{a} = + \mathrm{223 800 } \textrm{ J.mol}^{-1}\), puis
\(A= k_{1} \exp \left(\frac{E_{a}}{RT_{1}}\right) \approx \mathrm{9,7} . 10^{13} \textrm{mole. m}^{-3} . \textrm{ s}^{-1}\)
Solution détaillée
La représentation linéaire en papier "semi-log" d'une fonction \(k = f (1/T)\) suggère une fonction exponentielle, décroissante car la droite a une pente négative.
Nous représentons donc, par la loi d'Arrhenius, cette constante de vitesse :
\(k = A \exp \left(- \frac{E_{a}}{RT}\right)\) où \(A\) est une constante
Déterminons l'énergie d'activation \(E_a\) par élimination de la constante \(A\) par le rapport \(k_2 / k_1\) :
\(k_{1} = A \exp\left(-\frac{E_{a}}{RT_{1}}\right) \textrm{ et } k_{2} = A \exp \left(-\frac{E_{a}}{RT_{2}}\right)\)
d'où \(\ln \frac{k_{2}}{k_{1}} = -\frac{E_{a}}{R} \left(\frac{T_{1} - T_{2}}{T_{1} T_{2}}\right)\), et
\(E_{a} = +25172 ~R = +223800 \textrm{ J . mol}^{-1}\)
on en déduit la constante de la loi d'Arrhenius :
\(A = k_{1} \exp \left(\frac{E_{a}}{RT_{1}}\right) = \mathrm{6,4} \times 10^{-2} \exp \left(\frac{223800}{\mathrm{8,314} \times 770}\right)\)
\(A \approx \mathrm{9,7} \cdot 10^{13} \textrm{ mole .m}^{-3}. \textrm{s}^{-1}\)